[日本語] English
 万見
万見- EMDB-22212: Structure of the human mitochondrial ribosome-EF-G1 complex (ClassII) -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22212 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
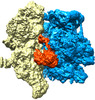
| タイトル | Structure of the human mitochondrial ribosome-EF-G1 complex (ClassII) | |||||||||
 マップデータ マップデータ | ClassII 55S-EF-G1mt complex | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.96 Å クライオ電子顕微鏡法 / 解像度: 3.96 Å | |||||||||
 データ登録者 データ登録者 | Sharma MR / Koripella RK / Agrawal RK | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Structures of the human mitochondrial ribosome bound to EF-G1 reveal distinct features of mitochondrial translation elongation. 著者: Ravi Kiran Koripella / Manjuli R Sharma / Kalpana Bhargava / Partha P Datta / Prem S Kaushal / Pooja Keshavan / Linda L Spremulli / Nilesh K Banavali / Rajendra K Agrawal /   要旨: The mammalian mitochondrial ribosome (mitoribosome) and its associated translational factors have evolved to accommodate greater participation of proteins in mitochondrial translation. Here we ...The mammalian mitochondrial ribosome (mitoribosome) and its associated translational factors have evolved to accommodate greater participation of proteins in mitochondrial translation. Here we present the 2.68-3.96 Å cryo-EM structures of the human 55S mitoribosome in complex with the human mitochondrial elongation factor G1 (EF-G1) in three distinct conformational states, including an intermediate state and a post-translocational state. These structures reveal the role of several mitochondria-specific (mito-specific) mitoribosomal proteins (MRPs) and a mito-specific segment of EF-G1 in mitochondrial tRNA (tRNA) translocation. In particular, the mito-specific C-terminal extension in EF-G1 is directly involved in translocation of the acceptor arm of the A-site tRNA. In addition to the ratchet-like and independent head-swiveling motions exhibited by the small mitoribosomal subunit, we discover significant conformational changes in MRP mL45 at the nascent polypeptide-exit site within the large mitoribosomal subunit that could be critical for tethering of the elongating mitoribosome onto the inner-mitochondrial membrane. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22212.map.gz emd_22212.map.gz | 224.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22212-v30.xml emd-22212-v30.xml emd-22212.xml emd-22212.xml | 8.7 KB 8.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_22212.png emd_22212.png | 219.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22212 http://ftp.pdbj.org/pub/emdb/structures/EMD-22212 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22212 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22212 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6vlzC  6vmiC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10481 (タイトル: Structures of the human mitochondrial ribosome bound to EF-G1 reveal distinct features of mitochondrial translation elongation EMPIAR-10481 (タイトル: Structures of the human mitochondrial ribosome bound to EF-G1 reveal distinct features of mitochondrial translation elongationData size: 753.5 Data #1: Aligned single-frame particles of human mitochondrial 55S-EF-Gmt complex [picked particles - single frame - processed]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22212.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22212.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | ClassII 55S-EF-G1mt complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.0961 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human mitochondrial ribosome-EF-G1 complex
| 全体 | 名称: Human mitochondrial ribosome-EF-G1 complex |
|---|---|
| 要素 |
|
-超分子 #1: Human mitochondrial ribosome-EF-G1 complex
| 超分子 | 名称: Human mitochondrial ribosome-EF-G1 complex / タイプ: complex / ID: 1 / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.6 |
|---|---|
| グリッド | 詳細: unspecified |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源: OTHER |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER |
| 撮影 | #0 - Image recording ID: 1 #0 - フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) #0 - 平均電子線量: 69.21 e/Å2 / #1 - Image recording ID: 2 #1 - フィルム・検出器のモデル: DIRECT ELECTRON DE-16 (4k x 4k) #1 - 検出モード: COUNTING / #1 - 平均電子線量: 70.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.96 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 25755 |
| Image recording ID | 1 |
 ムービー
ムービー コントローラー
コントローラー