+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1dyl | ||||||
|---|---|---|---|---|---|---|---|
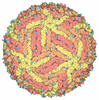
| タイトル | 9 ANGSTROM RESOLUTION CRYO-EM RECONSTRUCTION STRUCTURE OF SEMLIKI FOREST VIRUS (SFV) AND FITTING OF THE CAPSID PROTEIN STRUCTURE IN THE EM DENSITY | ||||||
 要素 要素 | NUCLEOCAPSID PROTEIN ウイルス ウイルス | ||||||
 キーワード キーワード | VIRUS/VIRAL PROTEIN /  ALPHAVIRUS / SFV / ALPHAVIRUS / SFV /  CRYO-EM (低温電子顕微鏡法) / CRYO-EM (低温電子顕微鏡法) /  IMAGE RECONSTRUCTION / IMAGE RECONSTRUCTION /  ENVELOPED VIRUS (エンベロープ (ウイルス)) / ENVELOPED VIRUS (エンベロープ (ウイルス)) /  CAPSID PROTEIN (カプシド) / ICOSAHEDRAL VIRUS / VIRUS-VIRAL PROTEIN complex CAPSID PROTEIN (カプシド) / ICOSAHEDRAL VIRUS / VIRUS-VIRAL PROTEIN complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 トガビリン / T=4 icosahedral viral capsid / トガビリン / T=4 icosahedral viral capsid /  virion assembly / virion assembly /  small molecule binding / host cell endosome / symbiont-mediated suppression of host toll-like receptor signaling pathway / clathrin-dependent endocytosis of virus by host cell / serine-type endopeptidase activity / fusion of virus membrane with host endosome membrane / small molecule binding / host cell endosome / symbiont-mediated suppression of host toll-like receptor signaling pathway / clathrin-dependent endocytosis of virus by host cell / serine-type endopeptidase activity / fusion of virus membrane with host endosome membrane /  エンベロープ (ウイルス) ... エンベロープ (ウイルス) ... トガビリン / T=4 icosahedral viral capsid / トガビリン / T=4 icosahedral viral capsid /  virion assembly / virion assembly /  small molecule binding / host cell endosome / symbiont-mediated suppression of host toll-like receptor signaling pathway / clathrin-dependent endocytosis of virus by host cell / serine-type endopeptidase activity / fusion of virus membrane with host endosome membrane / small molecule binding / host cell endosome / symbiont-mediated suppression of host toll-like receptor signaling pathway / clathrin-dependent endocytosis of virus by host cell / serine-type endopeptidase activity / fusion of virus membrane with host endosome membrane /  エンベロープ (ウイルス) / host cell nucleus / virion attachment to host cell / host cell plasma membrane / virion membrane / structural molecule activity / エンベロープ (ウイルス) / host cell nucleus / virion attachment to host cell / host cell plasma membrane / virion membrane / structural molecule activity /  タンパク質分解 / タンパク質分解 /  RNA binding / RNA binding /  生体膜 生体膜類似検索 - 分子機能 | ||||||
| 生物種 |    SEMLIKI FOREST VIRUS (セムリキ森林ウイルス) SEMLIKI FOREST VIRUS (セムリキ森林ウイルス) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 9 Å クライオ電子顕微鏡法 / 解像度: 9 Å | ||||||
 データ登録者 データ登録者 | Mancini, E.J. / Clarke, M. / Gowen, B.E. / Rutten, T. / Fuller, S.D. | ||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2000 ジャーナル: Mol Cell / 年: 2000タイトル: Cryo-electron microscopy reveals the functional organization of an enveloped virus, Semliki Forest virus. 著者: E J Mancini / M Clarke / B E Gowen / T Rutten / S D Fuller /  要旨: Semliki Forest virus serves as a paradigm for membrane fusion and assembly. Our icosahedral reconstruction combined 5276 particle images from 48 cryo-electron micrographs and determined the virion ...Semliki Forest virus serves as a paradigm for membrane fusion and assembly. Our icosahedral reconstruction combined 5276 particle images from 48 cryo-electron micrographs and determined the virion structure to 9 A resolution. The improved resolution of this map reveals an N-terminal arm linking capsid subunits and defines the spike-capsid interaction sites. It illustrates the paired helical nature of the transmembrane segments and the elongated structures connecting them to the spike projecting domains. A 10 A diameter density in the fusion protein lines the cavity at the center of the spike. These clearly visible features combine with the variation in order between the layers to provide a framework for understanding the structural changes during the life cycle of an enveloped virus. | ||||||
| 履歴 |
| ||||||
| Remark 700 | SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS [A,B,C,D]C IN EACH CHAIN ON SHEET RECORDS ... SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS [A,B,C,D]C IN EACH CHAIN ON SHEET RECORDS BELOW IS ACTUALLY AN 6-STRANDED BARREL THIS IS REPRESENTED BY A 7-STRANDED SHEET IN WHICH THE FIRST AND LAST STRANDS ARE IDENTICAL. |
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1dyl.cif.gz 1dyl.cif.gz | 122 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1dyl.ent.gz pdb1dyl.ent.gz | 99.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1dyl.json.gz 1dyl.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/dy/1dyl https://data.pdbj.org/pub/pdb/validation_reports/dy/1dyl ftp://data.pdbj.org/pub/pdb/validation_reports/dy/1dyl ftp://data.pdbj.org/pub/pdb/validation_reports/dy/1dyl | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | x 60
|
| 2 |
|
| 3 | x 5
|
| 4 | x 6
|
| 5 | 
|
| 対称性 | 点対称性: (シェーンフリース記号 : I (正20面体型対称 : I (正20面体型対称 )) )) |
- 要素
要素
| #1: タンパク質 |  ウイルス ウイルス分子量: 16252.439 Da / 分子数: 4 / 由来タイプ: 天然 由来: (天然)    SEMLIKI FOREST VIRUS (セムリキ森林ウイルス) SEMLIKI FOREST VIRUS (セムリキ森林ウイルス)細胞株: BABY HAMSTER KIDNEY 21 / 細胞内の位置: EXTRACELLULAR  Glossary of biology / 参照: UniProt: P03315 Glossary of biology / 参照: UniProt: P03315配列の詳細 | THE STRUCTURE STUDIED IS FOR THE COMPLETE VIRUS. THE FOLLOWING RESIDUES AND CHAINS ARE NOT REPORTED ...THE STRUCTURE STUDIED IS FOR THE COMPLETE VIRUS. THE FOLLOWING RESIDUES AND CHAINS ARE NOT REPORTED IN THIS ENTRY: MET A 1 TO ASP A 118 SER A 268 TO ARG A 1253 MET B 1 TO ASP B 118 SER B 268 TO ARG B 1253 MET C 1 TO ASP C 118 SER C 268 TO ARG C 1253 MET D 1 TO ASP D 118 SER D 268 TO ARG D 1253 AND CHAINS FOR THE SPIKE GLYCOPROTE | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: SEMLIKI FOREST VIRUS / タイプ: VIRUS / タイプ: VIRUS |
|---|---|
| 緩衝液 | pH: 7.6 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | 詳細: 400 MESH COPPER, HOLEY CARBON, GLOW DISCHARGE, / グリッドの材料: COPPER / グリッドのサイズ: 400 divisions/in. |
急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE 詳細: PLUNGE VITRIFICATION SAMPLES PREPARED AS THIN LAYERS OF VITREOUS ICE MAINTAINED AT NEAR LIQUID NITROGEN TEMPERATURE IN THE ELECTRON MICROSCOPE WITH A GATAN 626-0300 CRYOTRANSFER HOLDER. |
結晶化 | *PLUS 手法: その他 / 詳細: Fuller, S.D., (1987) Cell. 48, 923. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: FEI/PHILIPS CM200FEG / 日付: 1998年6月15日 |
|---|---|
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 7600 nm / 最小 デフォーカス(公称値): 975 nm / Cs Bright-field microscopy / 倍率(公称値): 50000 X / 最大 デフォーカス(公称値): 7600 nm / 最小 デフォーカス(公称値): 975 nm / Cs : 2 mm : 2 mm |
| 試料ホルダ | 温度: 95 K / 傾斜角・最大: 0 ° / 傾斜角・最小: 0 ° |
| 撮影 | 電子線照射量: 10 e/Å2 / フィルム・検出器のモデル: KODAK SO-163 FILM |
| 画像スキャン | デジタル画像の数: 48 |
| 放射波長 | 相対比: 1 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 対称性 | 点対称性 : I (正20面体型対称 : I (正20面体型対称 ) ) | ||||||||||||
3次元再構成 | 手法: MODEL-BASED, POLAR-FOURIER- TRANSFORMATION (FULLER ET AL. 1996, J.STRUC.BIOL. 116, 48-55; BAKER AND CHENG 1996, J.STRUC.BIOL. 116, 120- 130) MODEL-BASED CROSS COMMOM LINES SEARCH AND ...手法: MODEL-BASED, POLAR-FOURIER- TRANSFORMATION (FULLER ET AL. 1996, J.STRUC.BIOL. 116, 48-55; BAKER AND CHENG 1996, J.STRUC.BIOL. 116, 120- 130) MODEL-BASED CROSS COMMOM LINES SEARCH AND REFINEMENT (CROWTHER ET AL. 1970, NATURE (LONDON) 226, 421- 425; FULLER ET AL. 1996, J.STRUC.BIOL. 11 48-55;FERLENGHI ET AL. 1998, J.MOL.BIOL. 283, 71-81) 解像度: 9 Å / 粒子像の数: 5267 / ピクセルサイズ(公称値): 2.64 Å / ピクセルサイズ(実測値): 2.52 Å 倍率補正: THE PIXEL SIZE OF THE CRYO-EM MAP WAS CALIBRATED AGAINST A LOW RESOLUTION DENSITY MAP CALCULATED FROM THE CRYSTAL STRUCTURE OF HRV16. DENSITIES WERE COMPARED BY CROSS- CORRELATION ...倍率補正: THE PIXEL SIZE OF THE CRYO-EM MAP WAS CALIBRATED AGAINST A LOW RESOLUTION DENSITY MAP CALCULATED FROM THE CRYSTAL STRUCTURE OF HRV16. DENSITIES WERE COMPARED BY CROSS- CORRELATION WITHIN A SPHERICAL SHELL OF INTERNAL RADIUS 110 ANGSTROMS AND EXTERNAL RADIUS OF 145 ANGSTROMS. 詳細: THE ORIENTATIONS WERE REFINED BY THE CROSS COMMON LINES LINES METHOD (SIMPLEX) AND THE POLAR FOURIER TRANSFORM METHOD USING A PARALLEL IMPLEMENTATION (PYPFT). THE EFFECTIVE RESOLUTION OF THE ...詳細: THE ORIENTATIONS WERE REFINED BY THE CROSS COMMON LINES LINES METHOD (SIMPLEX) AND THE POLAR FOURIER TRANSFORM METHOD USING A PARALLEL IMPLEMENTATION (PYPFT). THE EFFECTIVE RESOLUTION OF THE FINAL RECONSTRUCTED DENSITY WAS DETERMINED TO BE AT LEAST 9 ANGSTROMS, AS MEASURED BY RANDOMLY SPLITTING THE PARTICLES INTO TWO SETS AND CALCULATING THE FOURIER SHELL CORRELATION OBTAINED FROM SEPARATE RECONSTRUCTIONS (HARAUZ AND VAN HEEL 1986, OPTIK 73, 146-156). THE EIGENVALUE SPECTRUM GAVE AN INDICATION OF THE RANDOMNESS OF THE DATA THAT WAS INCLUDED IN THE RECONSTRUCTION. THE COMPLETENESS OF THE DATA WAS VERIFIED IN THAT ALL EIGENVALUES EXCEEDED 100. THE COORDINATES ARE IN THE P, Q, R FRAME IN ANGSTROM UNITS AND CORRESPOND TO ICOSAHEDRAL SYMMETRY AXES. THE ORIGIN IS CHOSEN AT THE CENTER OF THE VIRUS WITH P, Q AND R ALONG MUTUALLY PERPENDICULAR TWO-FOLD AXES OF THE ICOSAHEDRON. THEY SHOULD REMAIN IN THAT FRAME FOR THE EASE OF THE USER IN CREATING THE BIOLOGICALLY SIGNIFICANT VIRAL COMPLEX PARTICLE USING THE 60 ICOSAHEDRAL SYMMETRY OPERATORS. RESIDUES NOT VISIBLE IN THE ORIGINAL CRYSTAL STRUCTURES ARE NOT INCLUDED IN THE CRYO-EM STRUCTURE MODEL. FOR EXAMPLE, C RESIDUES 1-118, ARE NOT VISIBLE IN THE CRYSTAL STRUCTURE (PDB ENTRY 1VCQ) AND THEREFORE ARE NOT INCLUDED IN THE COORDINATES BELOW. 対称性のタイプ: POINT | ||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL / Target criteria: R-factor 詳細: METHOD--THE CRYSTAL STRUCTURE OF THE CAPSID PROTEIN FROM CHOI ET AL (1997) PROTEINS 3 27,345-359 (SUBUNIT A OF PDB FILE 1VCQ) WAS PLACED INTO THE CRYO-EM DENSITY MAP. THE CAPSID PROTEIN WAS ...詳細: METHOD--THE CRYSTAL STRUCTURE OF THE CAPSID PROTEIN FROM CHOI ET AL (1997) PROTEINS 3 27,345-359 (SUBUNIT A OF PDB FILE 1VCQ) WAS PLACED INTO THE CRYO-EM DENSITY MAP. THE CAPSID PROTEIN WAS FIRST MANUALLY POSITIONED INTO THE CRYO-EM DENSITY CORRESPONDING TO POSITIONS OF THE FOUR INDEPENDENT MONOMER DENSITIES BETWEEN THE INNER LEAFLET OF THE BILAYER AND THE RNA. THESE POSITIONS WERE THEN REFINED BY RIGID BODY REFINEMENT IN REAL SPACE WITH THE PROGRAM EMFIT (CHENG ET AL. 1995, CELL 80, 621-630). THE QUALITY OF THE FIT CAN BE SEEN FROM THE MAP DENSITY WITHIN THE PROTEIN. ALL 4563 ATOMS ARE IN DENSITY OF AT LEAST 4 SIGMA (96.73) ABOVE THE AVERAGE (512.04) , 1167 ATOMS ARE IN DENSITY BETWEEN 4 AND 5 SIGMA, 3174 ATOMS ARE IN DENSITY BETWEEN 5 AND 6 SIGMA, AND 222 ATOMS ARE IN DENSTY OF 6 SIGMA OR ABOVE. THE VARIATION IN DENSITY OVER THE FITTED PROTEIN CAN BE VISUALIZED WITH THE PSEUDO TEMPERATURE FACTOR. THE DENSITY VALUE AT EACH ATOM IS GIVEN IN THE 8TH COLUM (USUALLY THE OCCUPANCY) AS THE NUMBER OF STANDARD DEVIATION ABOVE BACKGROUND. COLUMN NINE (USUALLY THE TEMPERATURE FACTOR) CONTAINS THE VALUE OF THE RELATIVE DENSITY WITHIN THE FITTED PROTEIN SCALED LINEARLY SO THAT THE MINIMUM DENSITY IS 100.0 AND THE MAXIMUM DENSITY IS 1.0. THE ATOMS THAT LIE IN THE LOWER DENSITY REGIONS WILL HAVE THE HIGHEST PSEUDO TEMPERATURE FACTORS. REFINEMENT PROTOCOL--RIGID BODY REFINEMENT | ||||||||||||
| 原子モデル構築 | PDB-ID: 1DYL | ||||||||||||
| 精密化 | 最高解像度: 9 Å | ||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 9 Å
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj