+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human inward-rectifier potassium 2.1 channel (Kir2.1) | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Sensory perception of sour taste / Classical Kir channels / regulation of skeletal muscle contraction via regulation of action potential / relaxation of skeletal muscle / Phase 4 - resting membrane potential / magnesium ion transport / voltage-gated potassium channel activity involved in cardiac muscle cell action potential repolarization / membrane repolarization during action potential / membrane repolarization during cardiac muscle cell action potential /  regulation of resting membrane potential ...Sensory perception of sour taste / Classical Kir channels / regulation of skeletal muscle contraction via regulation of action potential / relaxation of skeletal muscle / Phase 4 - resting membrane potential / magnesium ion transport / voltage-gated potassium channel activity involved in cardiac muscle cell action potential repolarization / membrane repolarization during action potential / membrane repolarization during cardiac muscle cell action potential / regulation of resting membrane potential ...Sensory perception of sour taste / Classical Kir channels / regulation of skeletal muscle contraction via regulation of action potential / relaxation of skeletal muscle / Phase 4 - resting membrane potential / magnesium ion transport / voltage-gated potassium channel activity involved in cardiac muscle cell action potential repolarization / membrane repolarization during action potential / membrane repolarization during cardiac muscle cell action potential /  regulation of resting membrane potential / regulation of membrane repolarization / intracellular potassium ion homeostasis / positive regulation of potassium ion transmembrane transport / membrane depolarization during cardiac muscle cell action potential / regulation of resting membrane potential / regulation of membrane repolarization / intracellular potassium ion homeostasis / positive regulation of potassium ion transmembrane transport / membrane depolarization during cardiac muscle cell action potential /  inward rectifier potassium channel activity / cardiac muscle cell action potential involved in contraction / regulation of cardiac muscle cell contraction / regulation of monoatomic ion transmembrane transport / relaxation of cardiac muscle / potassium ion import across plasma membrane / regulation of heart rate by cardiac conduction / inward rectifier potassium channel activity / cardiac muscle cell action potential involved in contraction / regulation of cardiac muscle cell contraction / regulation of monoatomic ion transmembrane transport / relaxation of cardiac muscle / potassium ion import across plasma membrane / regulation of heart rate by cardiac conduction /  小胞体 / 小胞体 /  介在板 / 介在板 /  小胞体 / 小胞体 /  voltage-gated potassium channel complex / potassium ion transmembrane transport / voltage-gated potassium channel complex / potassium ion transmembrane transport /  横行小管 / 横行小管 /  phosphatidylinositol-4,5-bisphosphate binding / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / potassium ion transport / cellular response to mechanical stimulus / phosphatidylinositol-4,5-bisphosphate binding / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / potassium ion transport / cellular response to mechanical stimulus /  postsynaptic membrane / protein homotetramerization / postsynaptic membrane / protein homotetramerization /  樹状突起スパイン / neuronal cell body / glutamatergic synapse / 樹状突起スパイン / neuronal cell body / glutamatergic synapse /  ゴルジ体 / ゴルジ体 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
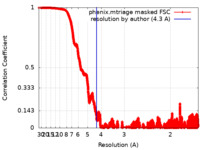
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.3 Å クライオ電子顕微鏡法 / 解像度: 4.3 Å | ||||||||||||
 データ登録者 データ登録者 | Fernandes CAH / Venien-Bryan C / Fagnen C / Zuniga D | ||||||||||||
| 資金援助 |  フランス, 3件 フランス, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2022 ジャーナル: Sci Adv / 年: 2022タイトル: Cryo-electron microscopy unveils unique structural features of the human Kir2.1 channel. 著者: Carlos A H Fernandes / Dania Zuniga / Charline Fagnen / Valérie Kugler / Rosa Scala / Gérard Péhau-Arnaudet / Renaud Wagner / David Perahia / Saïd Bendahhou / Catherine Vénien-Bryan /  要旨: We present the first structure of the human Kir2.1 channel containing both transmembrane domain (TMD) and cytoplasmic domain (CTD). Kir2.1 channels are strongly inward-rectifying potassium channels ...We present the first structure of the human Kir2.1 channel containing both transmembrane domain (TMD) and cytoplasmic domain (CTD). Kir2.1 channels are strongly inward-rectifying potassium channels that play a key role in maintaining resting membrane potential. Their gating is modulated by phosphatidylinositol 4,5-bisphosphate (PIP). Genetically inherited defects in Kir2.1 channels are responsible for several rare human diseases, including Andersen's syndrome. The structural analysis (cryo-electron microscopy), surface plasmon resonance, and electrophysiological experiments revealed a well-connected network of interactions between the PIP-binding site and the G-loop through residues R312 and H221. In addition, molecular dynamics simulations and normal mode analysis showed the intrinsic tendency of the CTD to tether to the TMD and a movement of the secondary anionic binding site to the membrane even without PIP. Our results revealed structural features unique to human Kir2.1 and provided insights into the connection between G-loop and gating and the pathological mechanisms associated with this channel. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14678.map.gz emd_14678.map.gz | 28.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14678-v30.xml emd-14678-v30.xml emd-14678.xml emd-14678.xml | 21.9 KB 21.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14678_fsc.xml emd_14678_fsc.xml | 1.7 MB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14678.png emd_14678.png | 73.6 KB | ||
| その他 |  emd_14678_half_map_1.map.gz emd_14678_half_map_1.map.gz emd_14678_half_map_2.map.gz emd_14678_half_map_2.map.gz | 20.4 MB 20.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14678 http://ftp.pdbj.org/pub/emdb/structures/EMD-14678 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14678 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14678 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7zdzMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14678.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14678.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.86 Å | ||||||||||||||||||||||||||||||||||||
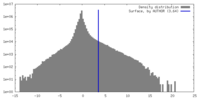
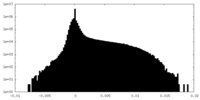
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_14678_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
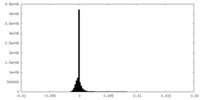
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_14678_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
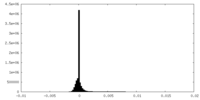
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human inward-rectifier potassium channel 2.1 (Kir2.1)
| 全体 | 名称: Human inward-rectifier potassium channel 2.1 (Kir2.1) |
|---|---|
| 要素 |
|
-超分子 #1: Human inward-rectifier potassium channel 2.1 (Kir2.1)
| 超分子 | 名称: Human inward-rectifier potassium channel 2.1 (Kir2.1) タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 実験値: 50 kDa/nm |
| 組換発現 | 生物種:   Komagataella pastoris (菌類) Komagataella pastoris (菌類) |
-分子 #1: Inward rectifier potassium channel 2
| 分子 | 名称: Inward rectifier potassium channel 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 48.344141 KDa |
| 組換発現 | 生物種:   Komagataella pastoris (菌類) Komagataella pastoris (菌類) |
| 配列 | 文字列: MGSVRTNRYS IVSSEEDGMK LATMAVANGF GNGKSKVHTR QQCRSRFVKK DGHCNVQFIN VGEKGQRYLA DIFTTCVDIR WRWMLVIFC LAFVLSWLFF GCVFWLIALL HGDLDASKEG KACVSEVNSF TAAFLFSIET QTTIGYGFRC VTDECPIAVF M VVFQSIVG ...文字列: MGSVRTNRYS IVSSEEDGMK LATMAVANGF GNGKSKVHTR QQCRSRFVKK DGHCNVQFIN VGEKGQRYLA DIFTTCVDIR WRWMLVIFC LAFVLSWLFF GCVFWLIALL HGDLDASKEG KACVSEVNSF TAAFLFSIET QTTIGYGFRC VTDECPIAVF M VVFQSIVG CIIDAFIIGA VMAKMAKPKK RNETLVFSHN AVIAMRDGKL CLMWRVGNLR KSHLVEAHVR AQLLKSRITS EG EYIPLDQ IDINVGFDSG IDRIFLVSPI TIVHEIDEDS PLYDLSKQDI DNADFEIVVI LEGMVEATAM TTQCRSSYLA NEI LWGHRY EPVLFEEKHY YKVDYSRFHK TYEVPNTPLC SARDLAEKKY ILSNANSFCY ENEVALTSKE EDDSENGVPE STST DTPPD IDLHNQASVP LEPRPLRRES EI |
-分子 #2: POTASSIUM ION
| 分子 | 名称: POTASSIUM ION / タイプ: ligand / ID: 2 / コピー数: 1 / 式: K |
|---|---|
| 分子量 | 理論値: 39.098 Da |
-分子 #3: STRONTIUM ION
| 分子 | 名称: STRONTIUM ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: SR |
|---|---|
| 分子量 | 理論値: 87.62 Da |
| Chemical component information |  ChemComp-SR: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.6 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / デジタル化 - サンプリング間隔: 10.0 µm / 撮影したグリッド数: 1 / 実像数: 9895 / 平均露光時間: 4.0 sec. / 平均電子線量: 61.7 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Residue range: 188-367 |
|---|---|
| 詳細 | For structural fitting, it was used dock-in-map (available at PHENIX) that uses both SSM and convolution-based shape searches to find a part of a map that is similar to a model. An initial in silico homology model of human Kir2.1 was generated using I-TASSER using the crystal structure of chicken Kir2.2 channel (PDB ID 3JYC) as a template. For building and refinement of the atomic model, the transmembrane domain (TMD, 55-184 region) of this in silico model was placed into the final sharpened cryo-EM map using the Dock in Map tool available in PHENIX. For the cytoplasmic domain (CTD; 188-367 region), the crystal structure of the CTD from mice Kir2.1 channel (PDB ID 1U4F) was placed into the final cryo-EM map using the same approach. Once the models were placed in the electron density, the loops that connect the two domains (185-187 region) and a N-terminal loop (41-54 region) absent in the in silico model were manually built using Coot. |
| 精密化 | 空間: REAL / プロトコル: OTHER / 温度因子: 404.73 / 当てはまり具合の基準: Correlation coefficient |
| 得られたモデル |  PDB-7zdz: |
 ムービー
ムービー コントローラー
コントローラー





 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)