+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7yuz | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Human K-Ras G12D (GDP-bound) in complex with cyclic peptide inhibitor AP8784 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  SIGNALING PROTEIN/INHIBITOR / SIGNALING PROTEIN/INHIBITOR /  ONCOLOGY (腫瘍学) / ONCOLOGY (腫瘍学) /  SIGNALING PROTEIN-INHIBITOR COMPLEX SIGNALING PROTEIN-INHIBITOR COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報forebrain astrocyte development / negative regulation of epithelial cell differentiation /  regulation of synaptic transmission, GABAergic / epithelial tube branching involved in lung morphogenesis / type I pneumocyte differentiation / Rac protein signal transduction / skeletal muscle cell differentiation / positive regulation of Rac protein signal transduction / Signaling by RAS GAP mutants / Signaling by RAS GTPase mutants ...forebrain astrocyte development / negative regulation of epithelial cell differentiation / regulation of synaptic transmission, GABAergic / epithelial tube branching involved in lung morphogenesis / type I pneumocyte differentiation / Rac protein signal transduction / skeletal muscle cell differentiation / positive regulation of Rac protein signal transduction / Signaling by RAS GAP mutants / Signaling by RAS GTPase mutants ...forebrain astrocyte development / negative regulation of epithelial cell differentiation /  regulation of synaptic transmission, GABAergic / epithelial tube branching involved in lung morphogenesis / type I pneumocyte differentiation / Rac protein signal transduction / skeletal muscle cell differentiation / positive regulation of Rac protein signal transduction / Signaling by RAS GAP mutants / Signaling by RAS GTPase mutants / Activation of RAS in B cells / RAS signaling downstream of NF1 loss-of-function variants / RUNX3 regulates p14-ARF / SOS-mediated signalling / Activated NTRK3 signals through RAS / Activated NTRK2 signals through RAS / SHC1 events in ERBB4 signaling / Signalling to RAS / glial cell proliferation / SHC-related events triggered by IGF1R / Activated NTRK2 signals through FRS2 and FRS3 / Estrogen-stimulated signaling through PRKCZ / SHC-mediated cascade:FGFR3 / MET activates RAS signaling / PTK6 Regulates RHO GTPases, RAS GTPase and MAP kinases / Signaling by PDGFRA transmembrane, juxtamembrane and kinase domain mutants / Signaling by PDGFRA extracellular domain mutants / SHC-mediated cascade:FGFR2 / SHC-mediated cascade:FGFR4 / Signaling by FGFR4 in disease / SHC-mediated cascade:FGFR1 / Erythropoietin activates RAS / protein-membrane adaptor activity / FRS-mediated FGFR3 signaling / Signaling by CSF3 (G-CSF) / positive regulation of glial cell proliferation / Signaling by FLT3 ITD and TKD mutants / homeostasis of number of cells within a tissue / FRS-mediated FGFR2 signaling / FRS-mediated FGFR4 signaling / Signaling by FGFR3 in disease / FRS-mediated FGFR1 signaling / p38MAPK events / Tie2 Signaling / Signaling by FGFR2 in disease / striated muscle cell differentiation / GRB2 events in EGFR signaling / SHC1 events in EGFR signaling / EGFR Transactivation by Gastrin / Signaling by FLT3 fusion proteins / FLT3 Signaling / Signaling by FGFR1 in disease / Ras activation upon Ca2+ influx through NMDA receptor / GRB2 events in ERBB2 signaling / NCAM signaling for neurite out-growth / CD209 (DC-SIGN) signaling / SHC1 events in ERBB2 signaling / Downstream signal transduction / Constitutive Signaling by Overexpressed ERBB2 / Insulin receptor signalling cascade / regulation of synaptic transmission, GABAergic / epithelial tube branching involved in lung morphogenesis / type I pneumocyte differentiation / Rac protein signal transduction / skeletal muscle cell differentiation / positive regulation of Rac protein signal transduction / Signaling by RAS GAP mutants / Signaling by RAS GTPase mutants / Activation of RAS in B cells / RAS signaling downstream of NF1 loss-of-function variants / RUNX3 regulates p14-ARF / SOS-mediated signalling / Activated NTRK3 signals through RAS / Activated NTRK2 signals through RAS / SHC1 events in ERBB4 signaling / Signalling to RAS / glial cell proliferation / SHC-related events triggered by IGF1R / Activated NTRK2 signals through FRS2 and FRS3 / Estrogen-stimulated signaling through PRKCZ / SHC-mediated cascade:FGFR3 / MET activates RAS signaling / PTK6 Regulates RHO GTPases, RAS GTPase and MAP kinases / Signaling by PDGFRA transmembrane, juxtamembrane and kinase domain mutants / Signaling by PDGFRA extracellular domain mutants / SHC-mediated cascade:FGFR2 / SHC-mediated cascade:FGFR4 / Signaling by FGFR4 in disease / SHC-mediated cascade:FGFR1 / Erythropoietin activates RAS / protein-membrane adaptor activity / FRS-mediated FGFR3 signaling / Signaling by CSF3 (G-CSF) / positive regulation of glial cell proliferation / Signaling by FLT3 ITD and TKD mutants / homeostasis of number of cells within a tissue / FRS-mediated FGFR2 signaling / FRS-mediated FGFR4 signaling / Signaling by FGFR3 in disease / FRS-mediated FGFR1 signaling / p38MAPK events / Tie2 Signaling / Signaling by FGFR2 in disease / striated muscle cell differentiation / GRB2 events in EGFR signaling / SHC1 events in EGFR signaling / EGFR Transactivation by Gastrin / Signaling by FLT3 fusion proteins / FLT3 Signaling / Signaling by FGFR1 in disease / Ras activation upon Ca2+ influx through NMDA receptor / GRB2 events in ERBB2 signaling / NCAM signaling for neurite out-growth / CD209 (DC-SIGN) signaling / SHC1 events in ERBB2 signaling / Downstream signal transduction / Constitutive Signaling by Overexpressed ERBB2 / Insulin receptor signalling cascade /  低分子量GTPアーゼ / G protein activity / Signaling by phosphorylated juxtamembrane, extracellular and kinase domain KIT mutants / VEGFR2 mediated cell proliferation / FCERI mediated MAPK activation / Signaling by ERBB2 TMD/JMD mutants / regulation of long-term neuronal synaptic plasticity / RAF activation / Signaling by high-kinase activity BRAF mutants / Constitutive Signaling by EGFRvIII / 低分子量GTPアーゼ / G protein activity / Signaling by phosphorylated juxtamembrane, extracellular and kinase domain KIT mutants / VEGFR2 mediated cell proliferation / FCERI mediated MAPK activation / Signaling by ERBB2 TMD/JMD mutants / regulation of long-term neuronal synaptic plasticity / RAF activation / Signaling by high-kinase activity BRAF mutants / Constitutive Signaling by EGFRvIII /  visual learning / MAP2K and MAPK activation / Signaling by ERBB2 ECD mutants / Signaling by ERBB2 KD Mutants / Signaling by SCF-KIT / cytoplasmic side of plasma membrane / Regulation of RAS by GAPs / Negative regulation of MAPK pathway / RAS processing / Signaling by RAF1 mutants / GDP binding / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by CSF1 (M-CSF) in myeloid cells / visual learning / MAP2K and MAPK activation / Signaling by ERBB2 ECD mutants / Signaling by ERBB2 KD Mutants / Signaling by SCF-KIT / cytoplasmic side of plasma membrane / Regulation of RAS by GAPs / Negative regulation of MAPK pathway / RAS processing / Signaling by RAF1 mutants / GDP binding / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by CSF1 (M-CSF) in myeloid cells /  分裂促進因子活性化タンパク質キナーゼ / Signaling by BRAF and RAF1 fusions / DAP12 signaling / Constitutive Signaling by Ligand-Responsive EGFR Cancer Variants / Ca2+ pathway / 分裂促進因子活性化タンパク質キナーゼ / Signaling by BRAF and RAF1 fusions / DAP12 signaling / Constitutive Signaling by Ligand-Responsive EGFR Cancer Variants / Ca2+ pathway /  遺伝子発現 / actin cytoskeleton organization / RAF/MAP kinase cascade / neuron apoptotic process / mitochondrial outer membrane / negative regulation of neuron apoptotic process / Ras protein signal transduction / positive regulation of protein phosphorylation / 遺伝子発現 / actin cytoskeleton organization / RAF/MAP kinase cascade / neuron apoptotic process / mitochondrial outer membrane / negative regulation of neuron apoptotic process / Ras protein signal transduction / positive regulation of protein phosphorylation /  ゴルジ体 / ゴルジ体 /  focal adhesion focal adhesion類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト)synthetic construct (人工物) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.878 Å 分子置換 / 解像度: 1.878 Å | ||||||
 データ登録者 データ登録者 | Irie, M. / Fukami, T.A. / Tanada, M. / Ohta, A. / Torizawa, T. | ||||||
| 資金援助 | 1件
| ||||||
 引用 引用 |  ジャーナル: J.Am.Chem.Soc. / 年: 2023 ジャーナル: J.Am.Chem.Soc. / 年: 2023タイトル: Validation of a New Methodology to Create Oral Drugs beyond the Rule of 5 for Intracellular Tough Targets. 著者: Ohta, A. / Tanada, M. / Shinohara, S. / Morita, Y. / Nakano, K. / Yamagishi, Y. / Takano, R. / Kariyuki, S. / Iida, T. / Matsuo, A. / Ozeki, K. / Emura, T. / Sakurai, Y. / Takano, K. / ...著者: Ohta, A. / Tanada, M. / Shinohara, S. / Morita, Y. / Nakano, K. / Yamagishi, Y. / Takano, R. / Kariyuki, S. / Iida, T. / Matsuo, A. / Ozeki, K. / Emura, T. / Sakurai, Y. / Takano, K. / Higashida, A. / Kojima, M. / Muraoka, T. / Takeyama, R. / Kato, T. / Kimura, K. / Ogawa, K. / Ohara, K. / Tanaka, S. / Kikuchi, Y. / Hisada, N. / Hayashi, R. / Nishimura, Y. / Nomura, K. / Tachibana, T. / Irie, M. / Kawada, H. / Torizawa, T. / Murao, N. / Kotake, T. / Tanaka, M. / Ishikawa, S. / Miyake, T. / Tamiya, M. / Arai, M. / Chiyoda, A. / Akai, S. / Sase, H. / Kuramoto, S. / Ito, T. / Shiraishi, T. / Kojima, T. / Iikura, H. #1:  ジャーナル: J.Am.Chem.Soc. / 年: 2023 ジャーナル: J.Am.Chem.Soc. / 年: 2023タイトル: Development of Orally Bioavailable Peptides Targeting an Intracellular Protein: From a Hit to a Clinical KRAS Inhibitor 著者: Tanada, M. / Tamiya, M. / Matsuo, A. / Chiyoda, A. / Takano, K. / Ito, T. / Irie, M. / Kotake, T. / Takeyama, R. / Kawada, H. / Hayashi, R. / Ishikawa, S. / Nomura, K. / Furuichi, N. / ...著者: Tanada, M. / Tamiya, M. / Matsuo, A. / Chiyoda, A. / Takano, K. / Ito, T. / Irie, M. / Kotake, T. / Takeyama, R. / Kawada, H. / Hayashi, R. / Ishikawa, S. / Nomura, K. / Furuichi, N. / Morita, Y. / Kage, M. / Hashimoto, S. / Nii, K. / Sase, H. / Ohara, K. / Ohta, A. / Kuramoto, S. / Nishimura, Y. / Iikura, H. / Shiraishi, T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7yuz.cif.gz 7yuz.cif.gz | 58.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7yuz.ent.gz pdb7yuz.ent.gz | 36.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7yuz.json.gz 7yuz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/yu/7yuz https://data.pdbj.org/pub/pdb/validation_reports/yu/7yuz ftp://data.pdbj.org/pub/pdb/validation_reports/yu/7yuz ftp://data.pdbj.org/pub/pdb/validation_reports/yu/7yuz | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  7yv1C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 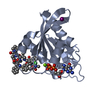
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 / タンパク質・ペプチド , 2種, 2分子 AI
| #1: タンパク質 | 分子量: 20150.582 Da / 分子数: 1 / 変異: G12D / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 発現宿主: Homo sapiens (ヒト) / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): Tuner(DE3)pLacI / 参照: UniProt: P01116 Escherichia coli (大腸菌) / 株 (発現宿主): Tuner(DE3)pLacI / 参照: UniProt: P01116 |
|---|---|
| #2: タンパク質・ペプチド | 分子量: 1435.537 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
-非ポリマー , 4種, 33分子 






| #3: 化合物 | ChemComp-GDP /  グアノシン二リン酸 グアノシン二リン酸 |
|---|---|
| #4: 化合物 | ChemComp-MG / |
| #5: 化合物 | ChemComp-IOD /  ヨウ化物 ヨウ化物 |
| #6: 水 | ChemComp-HOH /  水 水 |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.49 Å3/Da / 溶媒含有率: 50.55 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 詳細: 0.2 M Ammonium iodide, 20.0 %w/v Polyethylene glycol 3,350, and 25%v/v Ethylene glycol as a cryoprotectant |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SLS SLS  / ビームライン: X10SA / 波長: 1.000006 Å / ビームライン: X10SA / 波長: 1.000006 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS EIGER X 16M / 検出器: PIXEL / 日付: 2021年9月4日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 1.000006 Å / 相対比: 1 : 1.000006 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.878→34.45 Å / Num. obs: 12671 / % possible obs: 94 % / 冗長度: 19.28 % / CC1/2: 0.999 / Rmerge(I) obs: 0.0505 / Rpim(I) all: 0.0121 / Rrim(I) all: 0.052 / Net I/σ(I): 23.58 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 / 解像度: 1.878→34.45 Å / Cor.coef. Fo:Fc: 0.925 / Cor.coef. Fo:Fc free: 0.925 / SU R Cruickshank DPI: 0.255 / 交差検証法: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.255 / SU Rfree Blow DPI: 0.214 / SU Rfree Cruickshank DPI: 0.215 分子置換 / 解像度: 1.878→34.45 Å / Cor.coef. Fo:Fc: 0.925 / Cor.coef. Fo:Fc free: 0.925 / SU R Cruickshank DPI: 0.255 / 交差検証法: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.255 / SU Rfree Blow DPI: 0.214 / SU Rfree Cruickshank DPI: 0.215
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 96.69 Å2 / Biso mean: 56.01 Å2 / Biso min: 30.07 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.38 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.878→34.45 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.88→2.04 Å / Rfactor Rfree error: 0 / Total num. of bins used: 32
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj




















