+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7byn | ||||||
|---|---|---|---|---|---|---|---|
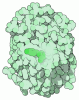
| タイトル | Cryo-EM structure of human KCNQ4 with linopirdine | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  KCNQ / Channel / KCNQ / Channel /  Calmodulin (カルモジュリン) / Calmodulin (カルモジュリン) /  PIP2 (ホスファチジルイノシトール4,5-ビスリン酸) / PIP2 (ホスファチジルイノシトール4,5-ビスリン酸) /  linopirdine linopirdine | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Voltage gated Potassium channels / Sensory processing of sound by outer hair cells of the cochlea / Sensory processing of sound by inner hair cells of the cochlea / negative regulation of high voltage-gated calcium channel activity / inner ear morphogenesis / negative regulation of calcium ion export across plasma membrane / regulation of cardiac muscle cell action potential / positive regulation of ryanodine-sensitive calcium-release channel activity / regulation of cell communication by electrical coupling involved in cardiac conduction / negative regulation of peptidyl-threonine phosphorylation ...Voltage gated Potassium channels / Sensory processing of sound by outer hair cells of the cochlea / Sensory processing of sound by inner hair cells of the cochlea / negative regulation of high voltage-gated calcium channel activity / inner ear morphogenesis / negative regulation of calcium ion export across plasma membrane / regulation of cardiac muscle cell action potential / positive regulation of ryanodine-sensitive calcium-release channel activity / regulation of cell communication by electrical coupling involved in cardiac conduction / negative regulation of peptidyl-threonine phosphorylation / protein phosphatase activator activity /  voltage-gated potassium channel activity / positive regulation of cyclic-nucleotide phosphodiesterase activity / voltage-gated potassium channel activity / positive regulation of cyclic-nucleotide phosphodiesterase activity /  potassium channel activity / positive regulation of phosphoprotein phosphatase activity / potassium channel activity / positive regulation of phosphoprotein phosphatase activity /  adenylate cyclase binding / adenylate cyclase binding /  catalytic complex / detection of calcium ion / negative regulation of ryanodine-sensitive calcium-release channel activity / regulation of cardiac muscle contraction / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / catalytic complex / detection of calcium ion / negative regulation of ryanodine-sensitive calcium-release channel activity / regulation of cardiac muscle contraction / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion /  voltage-gated potassium channel complex / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / positive regulation of protein dephosphorylation / regulation of calcium-mediated signaling / voltage-gated potassium channel complex / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / positive regulation of protein dephosphorylation / regulation of calcium-mediated signaling /  titin binding / positive regulation of protein autophosphorylation / potassium ion transmembrane transport / sperm midpiece / titin binding / positive regulation of protein autophosphorylation / potassium ion transmembrane transport / sperm midpiece /  calcium channel complex / substantia nigra development / adenylate cyclase activator activity / calcium channel complex / substantia nigra development / adenylate cyclase activator activity /  regulation of heart rate / protein serine/threonine kinase activator activity / regulation of heart rate / protein serine/threonine kinase activator activity /  sarcomere / sarcomere /  生物発光 / basal plasma membrane / 生物発光 / basal plasma membrane /  regulation of cytokinesis / positive regulation of peptidyl-threonine phosphorylation / generation of precursor metabolites and energy / sensory perception of sound / spindle microtubule / positive regulation of protein serine/threonine kinase activity / potassium ion transport / regulation of cytokinesis / positive regulation of peptidyl-threonine phosphorylation / generation of precursor metabolites and energy / sensory perception of sound / spindle microtubule / positive regulation of protein serine/threonine kinase activity / potassium ion transport /  紡錘体 / response to calcium ion / calcium-dependent protein binding / G2/M transition of mitotic cell cycle / 紡錘体 / response to calcium ion / calcium-dependent protein binding / G2/M transition of mitotic cell cycle /  髄鞘 / vesicle / transmembrane transporter binding / G protein-coupled receptor signaling pathway / 髄鞘 / vesicle / transmembrane transporter binding / G protein-coupled receptor signaling pathway /  中心体 / 中心体 /  calcium ion binding / calcium ion binding /  protein kinase binding / protein-containing complex / protein kinase binding / protein-containing complex /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Aequorea victoria (オワンクラゲ) Aequorea victoria (オワンクラゲ)  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.3 Å クライオ電子顕微鏡法 / 解像度: 3.3 Å | ||||||
 データ登録者 データ登録者 | Shen, H. / Li, T. / Yue, Z. | ||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2021 ジャーナル: Mol Cell / 年: 2021タイトル: Structural Basis for the Modulation of Human KCNQ4 by Small-Molecule Drugs. 著者: Tian Li / Kun Wu / Zhenlei Yue / Yifei Wang / Fan Zhang / Huaizong Shen /  要旨: Among the five KCNQ channels, also known as the K7 voltage-gated potassium (K) channels, KCNQ2-KCNQ5 control neuronal excitability. Dysfunctions of KCNQ2-KCNQ5 are associated with neurological ...Among the five KCNQ channels, also known as the K7 voltage-gated potassium (K) channels, KCNQ2-KCNQ5 control neuronal excitability. Dysfunctions of KCNQ2-KCNQ5 are associated with neurological disorders such as epilepsy, deafness, and neuropathic pain. Here, we report the cryoelectron microscopy (cryo-EM) structures of human KCNQ4 and its complexes with the opener retigabine or the blocker linopirdine at overall resolutions of 2.5, 3.1, and 3.3 Å, respectively. In all structures, a phosphatidylinositol 4,5-bisphosphate (PIP) molecule inserts its head group into a cavity within each voltage-sensing domain (VSD), revealing an unobserved binding mode for PIP. Retigabine nestles in each fenestration, inducing local shifts. Instead of staying within the central pore, linopirdine resides in a cytosolic cavity underneath the inner gate. Electrophysiological analyses of various mutants corroborated the structural observations. Our studies reveal the molecular basis for the modulatory mechanism of neuronal KCNQ channels and provide a framework for structure-facilitated drug discovery targeting these important channels. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7byn.cif.gz 7byn.cif.gz | 429.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7byn.ent.gz pdb7byn.ent.gz | 321.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7byn.json.gz 7byn.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/by/7byn https://data.pdbj.org/pub/pdb/validation_reports/by/7byn ftp://data.pdbj.org/pub/pdb/validation_reports/by/7byn ftp://data.pdbj.org/pub/pdb/validation_reports/by/7byn | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
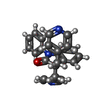
| #1: タンパク質 | 分子量: 109327.836 Da / 分子数: 4 / 変異: F64L/S65T/K107T/A206K/H231L / 由来タイプ: 組換発現 由来: (組換発現)   Aequorea victoria (オワンクラゲ), (組換発現) Aequorea victoria (オワンクラゲ), (組換発現)   Homo sapiens (ヒト) Homo sapiens (ヒト)遺伝子: GFP, KCNQ4 / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P42212, UniProt: P56696 Homo sapiens (ヒト) / 参照: UniProt: P42212, UniProt: P56696#2: タンパク質 |  カルモジュリン カルモジュリン分子量: 16852.545 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: CALM3, CALML2, CAM3, CAMC, CAMIII / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CALM3, CALML2, CAM3, CAMC, CAMIII / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P0DP25 Homo sapiens (ヒト) / 参照: UniProt: P0DP25#3: 化合物 | ChemComp-PT5 / [(  ホスファチジルイノシトール4,5-ビスリン酸 ホスファチジルイノシトール4,5-ビスリン酸#4: 化合物 | #5: 化合物 | ChemComp-FCC / |  Linopirdine Linopirdine研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Complex of human KCNQ4 and linopirdine / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 8 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.17.1_3660: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
3次元再構成 | 解像度: 3.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 229040 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj