登録情報 データベース : PDB / ID : 6ofoタイトル Crystal structure of split green fluorescent protein (GFP); s10 circular permutant (194-195) Green fluorescent protein (GFP); s10 circular permutant (194-195) キーワード / / 機能・相同性 / / / / / / 生物種 Aequorea victoria (オワンクラゲ)手法 / / / 解像度 : 2.603 Å データ登録者 Lin, C.-Y. / Romei, M.G. / Deller, M.C. / Doukov, T.I. / Boxer, S.G. 資金援助 組織 認可番号 国 National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) 118044
ジャーナル : J.Am.Chem.Soc. / 年 : 2019タイトル : Unified Model for Photophysical and Electro-Optical Properties of Green Fluorescent Proteins.著者 : Lin, C.Y. / Romei, M.G. / Oltrogge, L.M. / Mathews, I.I. / Boxer, S.G. 履歴 登録 2019年3月31日 登録サイト / 処理サイト 改定 1.0 2019年7月10日 Provider / タイプ 改定 1.1 2019年10月2日 Group / Database references / カテゴリ / citation_authorItem _citation.country / _citation.journal_abbrev ... _citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year / _citation_author.identifier_ORCID / _citation_author.name 改定 1.2 2020年1月1日 Group / カテゴリ / Item 改定 1.3 2023年10月11日 Group / Database references / Refinement descriptionカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_database_accession改定 2.0 2023年11月15日 Group / Data collection / Derived calculationsカテゴリ atom_site / atom_site_anisotrop ... atom_site / atom_site_anisotrop / chem_comp_atom / chem_comp_bond / pdbx_validate_main_chain_plane / pdbx_validate_rmsd_angle / struct_conn Item _atom_site.auth_atom_id / _atom_site.label_atom_id ... _atom_site.auth_atom_id / _atom_site.label_atom_id / _atom_site_anisotrop.pdbx_auth_atom_id / _atom_site_anisotrop.pdbx_label_atom_id / _chem_comp_atom.atom_id / _chem_comp_bond.atom_id_1 / _chem_comp_bond.atom_id_2 / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr2_label_atom_id
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード FLUORESCENT PROTEIN (蛍光タンパク質) / GFP / SPLIT FLUORESCENT PROTEIN
FLUORESCENT PROTEIN (蛍光タンパク質) / GFP / SPLIT FLUORESCENT PROTEIN 緑色蛍光タンパク質 /
緑色蛍光タンパク質 /  緑色蛍光タンパク質 /
緑色蛍光タンパク質 /  生物発光 / generation of precursor metabolites and energy /
生物発光 / generation of precursor metabolites and energy /  緑色蛍光タンパク質
緑色蛍光タンパク質 機能・相同性情報
機能・相同性情報
 Aequorea victoria (オワンクラゲ)
Aequorea victoria (オワンクラゲ) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.603 Å
分子置換 / 解像度: 2.603 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: J.Am.Chem.Soc. / 年: 2019
ジャーナル: J.Am.Chem.Soc. / 年: 2019 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6ofo.cif.gz
6ofo.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6ofo.ent.gz
pdb6ofo.ent.gz PDB形式
PDB形式 6ofo.json.gz
6ofo.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/of/6ofo
https://data.pdbj.org/pub/pdb/validation_reports/of/6ofo ftp://data.pdbj.org/pub/pdb/validation_reports/of/6ofo
ftp://data.pdbj.org/pub/pdb/validation_reports/of/6ofo リンク
リンク 集合体
集合体


 要素
要素
 Aequorea victoria (オワンクラゲ)
Aequorea victoria (オワンクラゲ)
 Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P42212*PLUS
Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P42212*PLUS 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL12-2 / 波長: 0.9795 Å
/ ビームライン: BL12-2 / 波長: 0.9795 Å : 0.9795 Å / 相対比: 1
: 0.9795 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー




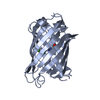

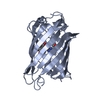






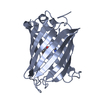














 PDBj
PDBj


