| 登録情報 | データベース: PDB / ID: 6obs
|
|---|
| タイトル | PP1 Y134K |
|---|
 要素 要素 | Serine/threonine-protein phosphatase PP1-alpha catalytic subunit |
|---|
 キーワード キーワード |  HYDROLASE (加水分解酵素) / HYDROLASE (加水分解酵素) /  phosphatase (ホスファターゼ) phosphatase (ホスファターゼ) |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.803 Å 分子置換 / 解像度: 1.803 Å |
|---|
 データ登録者 データ登録者 | Choy, M.S. / Moon, T.M. / Bray, J.A. / Archuleta, T.L. / Shi, W. / Peti, W. / Page, R. |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Human Genome Research Institute (NIH/NHGRI) | |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2019 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2019
タイトル: SDS22 selectively recognizes and traps metal-deficient inactive PP1.
著者: Choy, M.S. / Moon, T.M. / Ravindran, R. / Bray, J.A. / Robinson, L.C. / Archuleta, T.L. / Shi, W. / Peti, W. / Tatchell, K. / Page, R. |
|---|
| 履歴 | | 登録 | 2019年3月21日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2019年9月18日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2019年9月25日 | Group: Data collection / Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2019年10月2日 | Group: Data collection / Database references / カテゴリ: citation / citation_author
Item: _citation.pdbx_database_id_PubMed / _citation.title ..._citation.pdbx_database_id_PubMed / _citation.title / _citation_author.identifier_ORCID / _citation_author.name |
|---|
| 改定 1.3 | 2019年10月23日 | Group: Data collection / Database references / カテゴリ: citation / citation_author
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation_author.identifier_ORCID |
|---|
| 改定 1.4 | 2019年12月18日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.5 | 2023年10月11日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード HYDROLASE (加水分解酵素) /
HYDROLASE (加水分解酵素) /  phosphatase (ホスファターゼ)
phosphatase (ホスファターゼ) 機能・相同性情報
機能・相同性情報 グリコーゲン / regulation of glycogen biosynthetic process /
グリコーゲン / regulation of glycogen biosynthetic process /  protein phosphatase 1 binding / cadherin binding involved in cell-cell adhesion / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / regulation of canonical Wnt signaling pathway / regulation of translational initiation / myosin phosphatase activity ...regulation of glycogen catabolic process / PTW/PP1 phosphatase complex /
protein phosphatase 1 binding / cadherin binding involved in cell-cell adhesion / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / regulation of canonical Wnt signaling pathway / regulation of translational initiation / myosin phosphatase activity ...regulation of glycogen catabolic process / PTW/PP1 phosphatase complex /  グリコーゲン / regulation of glycogen biosynthetic process /
グリコーゲン / regulation of glycogen biosynthetic process /  protein phosphatase 1 binding / cadherin binding involved in cell-cell adhesion / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / regulation of canonical Wnt signaling pathway / regulation of translational initiation / myosin phosphatase activity / branching morphogenesis of an epithelial tube /
protein phosphatase 1 binding / cadherin binding involved in cell-cell adhesion / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / regulation of canonical Wnt signaling pathway / regulation of translational initiation / myosin phosphatase activity / branching morphogenesis of an epithelial tube /  protein serine/threonine phosphatase activity / glycogen metabolic process / protein-serine/threonine phosphatase / Triglyceride catabolism / entrainment of circadian clock by photoperiod /
protein serine/threonine phosphatase activity / glycogen metabolic process / protein-serine/threonine phosphatase / Triglyceride catabolism / entrainment of circadian clock by photoperiod /  phosphatase activity /
phosphatase activity /  phosphoprotein phosphatase activity / DARPP-32 events / ribonucleoprotein complex binding /
phosphoprotein phosphatase activity / DARPP-32 events / ribonucleoprotein complex binding /  脱リン酸化 / protein dephosphorylation / Downregulation of TGF-beta receptor signaling / response to lead ion /
脱リン酸化 / protein dephosphorylation / Downregulation of TGF-beta receptor signaling / response to lead ion /  接着結合 / circadian regulation of gene expression / lung development /
接着結合 / circadian regulation of gene expression / lung development /  regulation of circadian rhythm /
regulation of circadian rhythm /  Circadian Clock / presynapse /
Circadian Clock / presynapse /  perikaryon /
perikaryon /  樹状突起スパイン /
樹状突起スパイン /  細胞周期 /
細胞周期 /  細胞分裂 / glutamatergic synapse /
細胞分裂 / glutamatergic synapse /  核小体 / extracellular exosome /
核小体 / extracellular exosome /  核質 /
核質 /  metal ion binding /
metal ion binding /  細胞核 /
細胞核 /  細胞膜 /
細胞膜 /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 1.803 Å
分子置換 / 解像度: 1.803 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2019
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2019 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6obs.cif.gz
6obs.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6obs.ent.gz
pdb6obs.ent.gz PDB形式
PDB形式 6obs.json.gz
6obs.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/ob/6obs
https://data.pdbj.org/pub/pdb/validation_reports/ob/6obs ftp://data.pdbj.org/pub/pdb/validation_reports/ob/6obs
ftp://data.pdbj.org/pub/pdb/validation_reports/ob/6obs リンク
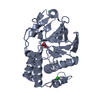
リンク 集合体
集合体
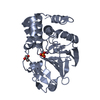

 要素
要素
 Homo sapiens (ヒト) / 遺伝子: PPP1CA, PPP1A / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PPP1CA, PPP1A / 発現宿主: 
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌) リン酸塩
リン酸塩 グリセリン
グリセリン 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 : 1.34 Å / 相対比: 1
: 1.34 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj














