+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6fvz | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of human monoamine oxidase B (MAO B) in complex with dimethylphenyl-chromone-carboxamide | ||||||
 要素 要素 | Amine oxidase [flavin-containing] B | ||||||
 キーワード キーワード |  FLAVOPROTEIN (フラボタンパク質) / FLAVOPROTEIN (フラボタンパク質) /  Parkinson's disease (パーキンソン病) / Parkinson's disease (パーキンソン病) /  drug design (医薬品設計) / drug design (医薬品設計) /  chromone (クロモン) / chromone (クロモン) /  inhibitor (酵素阻害剤) inhibitor (酵素阻害剤) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Biogenic amines are oxidatively deaminated to aldehydes by MAOA and MAOB /  monoamine oxidase activity / monoamine oxidase activity /  モノアミン酸化酵素 / phenylethylamine catabolic process / positive regulation of dopamine metabolic process / negative regulation of serotonin secretion / response to aluminum ion / response to selenium ion / aliphatic amine oxidase activity / dopamine catabolic process ...Biogenic amines are oxidatively deaminated to aldehydes by MAOA and MAOB / モノアミン酸化酵素 / phenylethylamine catabolic process / positive regulation of dopamine metabolic process / negative regulation of serotonin secretion / response to aluminum ion / response to selenium ion / aliphatic amine oxidase activity / dopamine catabolic process ...Biogenic amines are oxidatively deaminated to aldehydes by MAOA and MAOB /  monoamine oxidase activity / monoamine oxidase activity /  モノアミン酸化酵素 / phenylethylamine catabolic process / positive regulation of dopamine metabolic process / negative regulation of serotonin secretion / response to aluminum ion / response to selenium ion / aliphatic amine oxidase activity / dopamine catabolic process / モノアミン酸化酵素 / phenylethylamine catabolic process / positive regulation of dopamine metabolic process / negative regulation of serotonin secretion / response to aluminum ion / response to selenium ion / aliphatic amine oxidase activity / dopamine catabolic process /  一級アミンオキシダーゼ / 一級アミンオキシダーゼ /  primary amine oxidase activity / mitochondrial envelope / hydrogen peroxide biosynthetic process / response to corticosterone / substantia nigra development / response to toxic substance / primary amine oxidase activity / mitochondrial envelope / hydrogen peroxide biosynthetic process / response to corticosterone / substantia nigra development / response to toxic substance /  flavin adenine dinucleotide binding / response to ethanol / mitochondrial outer membrane / response to lipopolysaccharide / flavin adenine dinucleotide binding / response to ethanol / mitochondrial outer membrane / response to lipopolysaccharide /  electron transfer activity / response to xenobiotic stimulus / neuronal cell body / electron transfer activity / response to xenobiotic stimulus / neuronal cell body /  樹状突起 / 樹状突起 /  ミトコンドリア / identical protein binding ミトコンドリア / identical protein binding類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | ||||||
 データ登録者 データ登録者 | Reis, J. / Manzella, N. / Cagide, F. / Mialet-Perez, J. / Uriarte, E. / Parini, A. / Borges, F. / Binda, C. | ||||||
| 資金援助 |  イタリア, 1件 イタリア, 1件
| ||||||
 引用 引用 |  ジャーナル: J. Med. Chem. / 年: 2018 ジャーナル: J. Med. Chem. / 年: 2018タイトル: Tight-Binding Inhibition of Human Monoamine Oxidase B by Chromone Analogs: A Kinetic, Crystallographic, and Biological Analysis. 著者: Reis, J. / Manzella, N. / Cagide, F. / Mialet-Perez, J. / Uriarte, E. / Parini, A. / Borges, F. / Binda, C. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6fvz.cif.gz 6fvz.cif.gz | 233.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6fvz.ent.gz pdb6fvz.ent.gz | 184.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6fvz.json.gz 6fvz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fv/6fvz https://data.pdbj.org/pub/pdb/validation_reports/fv/6fvz ftp://data.pdbj.org/pub/pdb/validation_reports/fv/6fvz ftp://data.pdbj.org/pub/pdb/validation_reports/fv/6fvz | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  6fw0C  6fwcC  2v5zS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 実験データセット #1 | データ参照:  10.18430/m36fvz / データの種類: diffraction image data 10.18430/m36fvz / データの種類: diffraction image data |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 58837.730 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: MAOB / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MAOB / 発現宿主:   Komagataella pastoris (菌類) / 参照: UniProt: P27338, Komagataella pastoris (菌類) / 参照: UniProt: P27338,  モノアミン酸化酵素 モノアミン酸化酵素 |
|---|
-非ポリマー , 5種, 850分子 

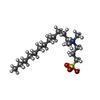






| #2: 化合物 |  フラビンアデニンジヌクレオチド フラビンアデニンジヌクレオチド#3: 化合物 | #4: 化合物 | #5: 化合物 |  グリセリン グリセリン#6: 水 | ChemComp-HOH / |  水 水 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.68 Å3/Da / 溶媒含有率: 54.18 % |
|---|---|
結晶化 | 温度: 277 K / 手法: 蒸気拡散法, シッティングドロップ法 詳細: 12% PEG4000, 100 mM ADA buffer pH 6.5, 70 mM lithium sulphate |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID23-2 / 波長: 0.987 Å / ビームライン: ID23-2 / 波長: 0.987 Å |
| 検出器 | タイプ: DECTRIS PILATUS3 X 2M / 検出器: PIXEL / 日付: 2016年9月20日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.987 Å / 相対比: 1 : 0.987 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→47 Å / Num. obs: 117061 / % possible obs: 99.4 % / 冗長度: 6.8 % / Rmerge(I) obs: 0.164 / Rpim(I) all: 0.102 / Net I/σ(I): 10.2 |
| 反射 シェル | 解像度: 1.8→1.83 Å |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 2v5z 解像度: 1.8→47 Å / Cor.coef. Fo:Fc: 0.957 / Cor.coef. Fo:Fc free: 0.935 / SU B: 2.571 / SU ML: 0.077 / 交差検証法: THROUGHOUT / ESU R: 0.103 / ESU R Free: 0.101 / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 17.89 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: 1 / 解像度: 1.8→47 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj




