+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4e9m | ||||||
|---|---|---|---|---|---|---|---|
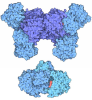
| タイトル | NOD1 card domain with three disulfide-clinched, domain-swapped dimers in the asymmetric unit | ||||||
 要素 要素 | Nucleotide-binding oligomerization domain-containing protein 1 | ||||||
 キーワード キーワード |  PROTEIN BINDING (タンパク質) / PROTEIN BINDING (タンパク質) /  INNATE IMMUNITY (自然免疫系) / INNATE IMMUNITY (自然免疫系) /  RIPK2 RIPK2 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of dendritic cell antigen processing and presentation / detection of biotic stimulus / positive regulation of xenophagy /  xenophagy / nucleotide-binding oligomerization domain containing 1 signaling pathway / cellular response to muramyl dipeptide / xenophagy / nucleotide-binding oligomerization domain containing 1 signaling pathway / cellular response to muramyl dipeptide /  CARD domain binding / CARD domain binding /  peptidoglycan binding / positive regulation of macrophage cytokine production / peptidoglycan binding / positive regulation of macrophage cytokine production /  pattern recognition receptor activity ...positive regulation of dendritic cell antigen processing and presentation / detection of biotic stimulus / positive regulation of xenophagy / pattern recognition receptor activity ...positive regulation of dendritic cell antigen processing and presentation / detection of biotic stimulus / positive regulation of xenophagy /  xenophagy / nucleotide-binding oligomerization domain containing 1 signaling pathway / cellular response to muramyl dipeptide / xenophagy / nucleotide-binding oligomerization domain containing 1 signaling pathway / cellular response to muramyl dipeptide /  CARD domain binding / CARD domain binding /  peptidoglycan binding / positive regulation of macrophage cytokine production / peptidoglycan binding / positive regulation of macrophage cytokine production /  pattern recognition receptor activity / pattern recognition receptor signaling pathway / cysteine-type endopeptidase activator activity involved in apoptotic process / positive regulation of cysteine-type endopeptidase activity involved in apoptotic process / detection of bacterium / JNK cascade / phagocytic vesicle / ERK1 and ERK2 cascade / response to endoplasmic reticulum stress / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / pattern recognition receptor activity / pattern recognition receptor signaling pathway / cysteine-type endopeptidase activator activity involved in apoptotic process / positive regulation of cysteine-type endopeptidase activity involved in apoptotic process / detection of bacterium / JNK cascade / phagocytic vesicle / ERK1 and ERK2 cascade / response to endoplasmic reticulum stress / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 /  ubiquitin binding / positive regulation of interleukin-1 beta production / activated TAK1 mediates p38 MAPK activation / positive regulation of interleukin-8 production / positive regulation of JNK cascade / TAK1-dependent IKK and NF-kappa-B activation / NOD1/2 Signaling Pathway / defense response / Interleukin-1 signaling / positive regulation of non-canonical NF-kappaB signal transduction / positive regulation of interleukin-6 production / activation of cysteine-type endopeptidase activity involved in apoptotic process / positive regulation of tumor necrosis factor production / Ovarian tumor domain proteases / positive regulation of NF-kappaB transcription factor activity / basolateral plasma membrane / positive regulation of canonical NF-kappaB signal transduction / defense response to Gram-negative bacterium / positive regulation of ERK1 and ERK2 cascade / intracellular signal transduction / defense response to Gram-positive bacterium / defense response to bacterium / ubiquitin binding / positive regulation of interleukin-1 beta production / activated TAK1 mediates p38 MAPK activation / positive regulation of interleukin-8 production / positive regulation of JNK cascade / TAK1-dependent IKK and NF-kappa-B activation / NOD1/2 Signaling Pathway / defense response / Interleukin-1 signaling / positive regulation of non-canonical NF-kappaB signal transduction / positive regulation of interleukin-6 production / activation of cysteine-type endopeptidase activity involved in apoptotic process / positive regulation of tumor necrosis factor production / Ovarian tumor domain proteases / positive regulation of NF-kappaB transcription factor activity / basolateral plasma membrane / positive regulation of canonical NF-kappaB signal transduction / defense response to Gram-negative bacterium / positive regulation of ERK1 and ERK2 cascade / intracellular signal transduction / defense response to Gram-positive bacterium / defense response to bacterium /  炎症 / apical plasma membrane / positive regulation of apoptotic process / 炎症 / apical plasma membrane / positive regulation of apoptotic process /  自然免疫系 / apoptotic process / protein-containing complex binding / SARS-CoV-2 activates/modulates innate and adaptive immune responses / 自然免疫系 / apoptotic process / protein-containing complex binding / SARS-CoV-2 activates/modulates innate and adaptive immune responses /  シグナル伝達 / protein homodimerization activity / シグナル伝達 / protein homodimerization activity /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.15 Å 分子置換 / 解像度: 2.15 Å | ||||||
 データ登録者 データ登録者 | Berry, E.A. / Huang, L.S. / Walker-Kopp, N. | ||||||
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Crystal structure of nod1 card domain with three disulfide-clinched, domain-swapped dimers in the asymmetric unit 著者: Berry, E.A. / Huang, L.S. / Walker-Kopp, N. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4e9m.cif.gz 4e9m.cif.gz | 126.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4e9m.ent.gz pdb4e9m.ent.gz | 98.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4e9m.json.gz 4e9m.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e9/4e9m https://data.pdbj.org/pub/pdb/validation_reports/e9/4e9m ftp://data.pdbj.org/pub/pdb/validation_reports/e9/4e9m ftp://data.pdbj.org/pub/pdb/validation_reports/e9/4e9m | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  2nz7S S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 6 | 
| ||||||||
| 7 | 
| ||||||||
| 8 | 
| ||||||||
| 9 | 
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | IT IS NOT KNOWN WHETHER THE DOMAIN-SWAPPED DIMERS SEEN HERE HAVE PHYSIOLOGICAL FUNCTION. CARD DOMAINS ARE KNOWN TO FORM HETERODIMERS WITH OTHER CARDS, BUT THIS IS NOT BELIEVED TO BE BY A DOMAIN-SWAPPING MECHANISM |
- 要素
要素
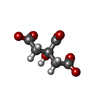
| #1: タンパク質 | 分子量: 16688.891 Da / 分子数: 6 / 断片: CARD DOMAIN / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: CARD4, NOD1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CARD4, NOD1 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: Q9Y239 Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: Q9Y239#2: 化合物 | ChemComp-FLC / |  クエン酸 クエン酸#3: 水 | ChemComp-HOH / |  水 水 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.01 Å3/Da / 溶媒含有率: 38.7 % |
|---|---|
結晶化 | 温度: 288 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.2 詳細: 2.07 M AMMONIUM CITRATE (DIBASIC), 6.7% (W/V) PEG3350, 10 mM TRIS-HCL FINAL PH ~5.2, VAPOR DIFFUSION, HANGING DROP, temperature 288K |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  CHESS CHESS  / ビームライン: A1 / 波長: 0.977 Å / ビームライン: A1 / 波長: 0.977 Å | ||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: ADSC QUANTUM 210 / 検出器: CCD / 日付: 2011年5月1日 | ||||||||||||||||||||||||||||||||||||
| 放射 | モノクロメーター: double, Horizontal focusing 5.05 asymmetric cut Si(111) プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 0.977 Å / 相対比: 1 : 0.977 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2.15→25 Å / Num. all: 34341 / Num. obs: 34341 / % possible obs: 75.9 % / Observed criterion σ(I): -3 / 冗長度: 3.6 % / Biso Wilson estimate: 39.4 Å2 / Rsym value: 0.084 / Net I/σ(I): 9.66 | ||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: PDB ENTRY 2NZ7 解像度: 2.15→24.84 Å / Rfactor Rfree error: 0.007 / Data cutoff high absF: 2255943.04 / Data cutoff low absF: 0 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber 詳細: UP TO 6-FOLD NCS RESTRAINTS ON COORDINATES WERE USED IN 9 NCS GROUPS, WITH NUMEROUS EXCEPTIONS FOR RESIDUES WITH DIFFERENT CONFORMATIONS. NO NCS RESTRAINTS WERE IMPOSED ON BFACTORS. Low ...詳細: UP TO 6-FOLD NCS RESTRAINTS ON COORDINATES WERE USED IN 9 NCS GROUPS, WITH NUMEROUS EXCEPTIONS FOR RESIDUES WITH DIFFERENT CONFORMATIONS. NO NCS RESTRAINTS WERE IMPOSED ON BFACTORS. Low completeness is due to use of data in corners of detector. sfcheck plot of completenes vs resolution shows good completeness to 2.6 Angstrom.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 49.3675 Å2 / ksol: 0.361962 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 51.7 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.15→24.84 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | NCS model details: RESTRAINED | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.15→2.26 Å / Rfactor Rfree error: 0.055 / Total num. of bins used: 7
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj