| 登録情報 | データベース: PDB / ID: 4dhy
|
|---|
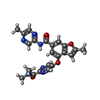
| タイトル | Crystal structure of human glucokinase in complex with glucose and activator |
|---|
 要素 要素 | Glucokinase グルコキナーゼ グルコキナーゼ |
|---|
 キーワード キーワード | TRANSFERASE/TRANSFERASE ACTIVATOR /  DIABETES MELLITUS (糖尿病) / DISEASE MUTATION / DIABETES MELLITUS (糖尿病) / DISEASE MUTATION /  GLYCOLYSIS (解糖系) / GLYCOLYSIS (解糖系) /  TRANSFERASE (転移酵素) / TRANSFERASE-TRANSFERASE ACTIVATOR complex TRANSFERASE (転移酵素) / TRANSFERASE-TRANSFERASE ACTIVATOR complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  フーリエ合成 / 解像度: 2.38 Å フーリエ合成 / 解像度: 2.38 Å |
|---|
 データ登録者 データ登録者 | Liu, S. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2012 ジャーナル: J.Biol.Chem. / 年: 2012
タイトル: Insights into Mechanism of Glucokinase Activation: OBSERVATION OF MULTIPLE DISTINCT PROTEIN CONFORMATIONS.
著者: Liu, S. / Ammirati, M.J. / Song, X. / Knafels, J.D. / Zhang, J. / Greasley, S.E. / Pfefferkorn, J.A. / Qiu, X. |
|---|
| 履歴 | | 登録 | 2012年1月30日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2012年2月8日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2012年4月11日 | Group: Database references |
|---|
| 改定 1.2 | 2012年5月9日 | Group: Database references |
|---|
| 改定 1.3 | 2020年7月29日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _chem_comp.name / _chem_comp.type ..._chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.4 | 2023年9月13日 | Group: Data collection / Database references ...Data collection / Database references / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 グルコキナーゼ
グルコキナーゼ  キーワード
キーワード DIABETES MELLITUS (糖尿病) / DISEASE MUTATION /
DIABETES MELLITUS (糖尿病) / DISEASE MUTATION /  GLYCOLYSIS (解糖系) /
GLYCOLYSIS (解糖系) /  TRANSFERASE (転移酵素) / TRANSFERASE-TRANSFERASE ACTIVATOR complex
TRANSFERASE (転移酵素) / TRANSFERASE-TRANSFERASE ACTIVATOR complex 機能・相同性情報
機能・相同性情報 mannokinase activity / glucose sensor activity / regulation of potassium ion transport /
mannokinase activity / glucose sensor activity / regulation of potassium ion transport /  ヘキソキナーゼ /
ヘキソキナーゼ /  fructokinase activity / carbohydrate phosphorylation /
fructokinase activity / carbohydrate phosphorylation /  glucokinase activity / glucose catabolic process / glucose 6-phosphate metabolic process ...Defective GCK causes maturity-onset diabetes of the young 2 (MODY2) /
glucokinase activity / glucose catabolic process / glucose 6-phosphate metabolic process ...Defective GCK causes maturity-onset diabetes of the young 2 (MODY2) /  mannokinase activity / glucose sensor activity / regulation of potassium ion transport /
mannokinase activity / glucose sensor activity / regulation of potassium ion transport /  ヘキソキナーゼ /
ヘキソキナーゼ /  fructokinase activity / carbohydrate phosphorylation /
fructokinase activity / carbohydrate phosphorylation /  glucokinase activity / glucose catabolic process / glucose 6-phosphate metabolic process / NADP metabolic process / Regulation of Glucokinase by Glucokinase Regulatory Protein / Defective TPR may confer susceptibility towards thyroid papillary carcinoma (TPC) /
glucokinase activity / glucose catabolic process / glucose 6-phosphate metabolic process / NADP metabolic process / Regulation of Glucokinase by Glucokinase Regulatory Protein / Defective TPR may confer susceptibility towards thyroid papillary carcinoma (TPC) /  D-glucose binding / cellular response to leptin stimulus / calcium ion import / canonical glycolysis /
D-glucose binding / cellular response to leptin stimulus / calcium ion import / canonical glycolysis /  解糖系 / regulation of glycolytic process / intracellular glucose homeostasis /
解糖系 / regulation of glycolytic process / intracellular glucose homeostasis /  Regulation of gene expression in beta cells / regulation of insulin secretion / positive regulation of glycogen biosynthetic process / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / negative regulation of gluconeogenesis / response to glucose / glycolytic process / positive regulation of insulin secretion / cellular response to insulin stimulus / glucose metabolic process /
Regulation of gene expression in beta cells / regulation of insulin secretion / positive regulation of glycogen biosynthetic process / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / negative regulation of gluconeogenesis / response to glucose / glycolytic process / positive regulation of insulin secretion / cellular response to insulin stimulus / glucose metabolic process /  glucose homeostasis /
glucose homeostasis /  ミトコンドリア /
ミトコンドリア /  核質 /
核質 /  ATP binding /
ATP binding /  細胞質基質
細胞質基質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  フーリエ合成 / 解像度: 2.38 Å
フーリエ合成 / 解像度: 2.38 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2012
ジャーナル: J.Biol.Chem. / 年: 2012 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4dhy.cif.gz
4dhy.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4dhy.ent.gz
pdb4dhy.ent.gz PDB形式
PDB形式 4dhy.json.gz
4dhy.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/dh/4dhy
https://data.pdbj.org/pub/pdb/validation_reports/dh/4dhy ftp://data.pdbj.org/pub/pdb/validation_reports/dh/4dhy
ftp://data.pdbj.org/pub/pdb/validation_reports/dh/4dhy リンク
リンク 集合体
集合体
 要素
要素 グルコキナーゼ / Hexokinase type IV / HK IV / Hexokinase-4 / HK4 / Hexokinase-D
グルコキナーゼ / Hexokinase type IV / HK IV / Hexokinase-4 / HK4 / Hexokinase-D
 Homo sapiens (ヒト) / 遺伝子: GCK / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: GCK / 発現宿主: 
 Escherichia coli (大腸菌) / 参照: UniProt: P35557,
Escherichia coli (大腸菌) / 参照: UniProt: P35557,  グルコキナーゼ
グルコキナーゼ グルコース
グルコース 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 回転陽極 / タイプ: RIGAKU MICROMAX-007 / 波長: 1.5418 Å
回転陽極 / タイプ: RIGAKU MICROMAX-007 / 波長: 1.5418 Å : 1.5418 Å / 相対比: 1
: 1.5418 Å / 相対比: 1  解析
解析 :
:  フーリエ合成
フーリエ合成 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj