+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4coo | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of human cystathionine beta-synthase (delta516-525) at 2.0 angstrom resolution | ||||||
 要素 要素 | CYSTATHIONINE BETA-SYNTHASE Cystathionine beta synthase Cystathionine beta synthase | ||||||
 キーワード キーワード |  LYASE (リアーゼ) / METHIONINE CYCLE / LYASE (リアーゼ) / METHIONINE CYCLE /  METABOLIC PATHWAY (代謝経路) / METABOLIC PATHWAY (代謝経路) /  ALLOSTERIC REGULATION (アロステリック効果) / ALLOSTERIC REGULATION (アロステリック効果) /  SERINE METABOLISM (セリン) SERINE METABOLISM (セリン) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Cysteine formation from homocysteine / homocysteine catabolic process / modified amino acid binding /  cystathionine beta-synthase / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process / cystathionine beta-synthase / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process /  cystathionine beta-synthase activity / cystathionine beta-synthase activity /  carbon monoxide binding / hydrogen sulfide biosynthetic process ...Cysteine formation from homocysteine / homocysteine catabolic process / modified amino acid binding / carbon monoxide binding / hydrogen sulfide biosynthetic process ...Cysteine formation from homocysteine / homocysteine catabolic process / modified amino acid binding /  cystathionine beta-synthase / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process / cystathionine beta-synthase / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process /  cystathionine beta-synthase activity / cystathionine beta-synthase activity /  carbon monoxide binding / hydrogen sulfide biosynthetic process / L-serine metabolic process / cartilage development involved in endochondral bone morphogenesis / regulation of nitric oxide mediated signal transduction / L-cysteine catabolic process / cysteine biosynthetic process / carbon monoxide binding / hydrogen sulfide biosynthetic process / L-serine metabolic process / cartilage development involved in endochondral bone morphogenesis / regulation of nitric oxide mediated signal transduction / L-cysteine catabolic process / cysteine biosynthetic process /  cysteine synthase activity / cerebellum morphogenesis / L-cysteine desulfhydrase activity / L-serine catabolic process / cysteine synthase activity / cerebellum morphogenesis / L-cysteine desulfhydrase activity / L-serine catabolic process /  nitric oxide binding / cysteine biosynthetic process from serine / DNA protection / nitric oxide binding / cysteine biosynthetic process from serine / DNA protection /  transsulfuration / transsulfuration /  endochondral ossification / endochondral ossification /  S-adenosyl-L-methionine binding / response to folic acid / S-adenosyl-L-methionine binding / response to folic acid /  nitrite reductase (NO-forming) activity / superoxide metabolic process / maternal process involved in female pregnancy / blood vessel remodeling / blood vessel diameter maintenance / nitrite reductase (NO-forming) activity / superoxide metabolic process / maternal process involved in female pregnancy / blood vessel remodeling / blood vessel diameter maintenance /  oxygen binding / oxygen binding /  pyridoxal phosphate binding / cellular response to hypoxia / pyridoxal phosphate binding / cellular response to hypoxia /  ubiquitin protein ligase binding / ubiquitin protein ligase binding /  heme binding / negative regulation of apoptotic process / heme binding / negative regulation of apoptotic process /  enzyme binding / protein homodimerization activity / identical protein binding / enzyme binding / protein homodimerization activity / identical protein binding /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | McCorvie, T.J. / Kopec, J. / Vollamar, M. / Strain-Damerell, C. / Bushell, S. / Bradley, A. / Tallant, C. / Kiyani, W. / Froese, D.S. / Carpenter, E.S. ...McCorvie, T.J. / Kopec, J. / Vollamar, M. / Strain-Damerell, C. / Bushell, S. / Bradley, A. / Tallant, C. / Kiyani, W. / Froese, D.S. / Carpenter, E.S. / Burgess-Brown, N. / von Delft, F. / Arrowsmith, C. / Edwards, A. / Bountra, C. / Yue, W.W. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2014 ジャーナル: J.Biol.Chem. / 年: 2014タイトル: Inter-Domain Communication of Human Cystathionine Beta Synthase: Structural Basis of S-Adenosyl-L-Methionine Activation. 著者: Mccorvie, T.J. / Kopec, J. / Hyung, S. / Fitzpatrick, F. / Feng, X. / Termine, D. / Strain-Damerell, C. / Vollmar, M. / Fleming, J. / Janz, J.M. / Bulawa, C. / Yue, W.W. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4coo.cif.gz 4coo.cif.gz | 403.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4coo.ent.gz pdb4coo.ent.gz | 328.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4coo.json.gz 4coo.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/co/4coo https://data.pdbj.org/pub/pdb/validation_reports/co/4coo ftp://data.pdbj.org/pub/pdb/validation_reports/co/4coo ftp://data.pdbj.org/pub/pdb/validation_reports/co/4coo | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 |  Cystathionine beta synthase / BETA-THIONASE / SERINE SULFHYDRASE Cystathionine beta synthase / BETA-THIONASE / SERINE SULFHYDRASE分子量: 62132.949 Da / 分子数: 2 断片: CATALYTIC AND REGULATORY DOMAINS, RESIDUES 1-515,526-551 由来タイプ: 組換発現 / 由来: (組換発現)   HOMO SAPIENS (ヒト) / 発現宿主: HOMO SAPIENS (ヒト) / 発現宿主:   ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): BL21(DE3) / Variant (発現宿主): R3-PRARE2 / 参照: UniProt: P35520, ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): BL21(DE3) / Variant (発現宿主): R3-PRARE2 / 参照: UniProt: P35520,  cystathionine beta-synthase cystathionine beta-synthase |
|---|
-非ポリマー , 7種, 313分子 



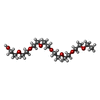








| #2: 化合物 |  Heme B Heme B#3: 化合物 | ChemComp-ACT /  酢酸塩 酢酸塩#4: 化合物 |  ピリドキサールリン酸 ピリドキサールリン酸#5: 化合物 | ChemComp-EDO /  エチレングリコール エチレングリコール#6: 化合物 | ChemComp-PE4 / |  ポリエチレングリコール ポリエチレングリコール#7: 化合物 | #8: 水 | ChemComp-HOH / |  水 水 |
|---|
-詳細
| 配列の詳細 | THE CONSTRUCT USED HERE CONTAINS A DELETION OF AMINO ACIDS 516-525 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.89 Å3/Da / 溶媒含有率: 57.42 % / 解説: NONE |
|---|---|
結晶化 | 詳細: 18% PEG8000, 0.1 M CACODYLATE, PH 6.6 0.2 M SODIUM ACETATE |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Diamond Diamond  / ビームライン: I04 / 波長: 0.9795 / ビームライン: I04 / 波長: 0.9795 |
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2013年6月22日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.9795 Å / 相対比: 1 : 0.9795 Å / 相対比: 1 |
| 反射 | 解像度: 2→48.89 Å / Num. obs: 93295 / % possible obs: 99.8 % / Observed criterion σ(I): 2 / 冗長度: 4.5 % / Rmerge(I) obs: 0.07 / Net I/σ(I): 15.1 |
| 反射 シェル | 解像度: 2→2.03 Å / 冗長度: 4.6 % / Rmerge(I) obs: 0.85 / Mean I/σ(I) obs: 2 / % possible all: 99.8 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: PDB ENTRY 1JBQ 解像度: 2→95.56 Å / Cor.coef. Fo:Fc: 0.966 / Cor.coef. Fo:Fc free: 0.95 / SU B: 7.023 / SU ML: 0.098 / 交差検証法: THROUGHOUT / ESU R: 0.134 / ESU R Free: 0.123 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 43.704 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→95.56 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj






