| 登録情報 | データベース: PDB / ID: 3gqy
|
|---|
| タイトル | Activator-Bound Structure of Human Pyruvate Kinase M2 |
|---|
 要素 要素 | Pyruvate kinase isozymes M1/M2 |
|---|
 キーワード キーワード |  TRANSFERASE (転移酵素) / activator / TRANSFERASE (転移酵素) / activator /  Acetylation (アセチル化) / Acetylation (アセチル化) /  Allosteric enzyme / Allosteric enzyme /  Alternative splicing (選択的スプライシング) / Alternative splicing (選択的スプライシング) /  Glycolysis (解糖系) / Glycolysis (解糖系) /  Kinase (キナーゼ) / Kinase (キナーゼ) /  Magnesium (マグネシウム) / Metal-binding / Magnesium (マグネシウム) / Metal-binding /  Phosphoprotein / Polymorphism / Phosphoprotein / Polymorphism /  Pyruvate (ピルビン酸) / Pyruvate (ピルビン酸) /  Structural Genomics (構造ゲノミクス) / Structural Genomics (構造ゲノミクス) /  Structural Genomics Consortium / SGC Structural Genomics Consortium / SGC |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
 ピルビン酸キナーゼ / ピルビン酸キナーゼ /  pyruvate kinase activity / positive regulation of cytoplasmic translation / pyruvate kinase activity / positive regulation of cytoplasmic translation /  プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis / プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis /  解糖系 / positive regulation of sprouting angiogenesis / 解糖系 / positive regulation of sprouting angiogenesis /  potassium ion binding / potassium ion binding /  小胞体 ... 小胞体 ... ピルビン酸キナーゼ / ピルビン酸キナーゼ /  pyruvate kinase activity / positive regulation of cytoplasmic translation / pyruvate kinase activity / positive regulation of cytoplasmic translation /  プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis / プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis /  解糖系 / positive regulation of sprouting angiogenesis / 解糖系 / positive regulation of sprouting angiogenesis /  potassium ion binding / potassium ion binding /  小胞体 / glycolytic process / 小胞体 / glycolytic process /  non-specific protein-tyrosine kinase / non-specific protein-tyrosine kinase /  繊毛 / cellular response to insulin stimulus / 繊毛 / cellular response to insulin stimulus /  extracellular vesicle / MHC class II protein complex binding / extracellular vesicle / MHC class II protein complex binding /  protein tyrosine kinase activity / secretory granule lumen / collagen-containing extracellular matrix / vesicle / ficolin-1-rich granule lumen / protein tyrosine kinase activity / secretory granule lumen / collagen-containing extracellular matrix / vesicle / ficolin-1-rich granule lumen /  transcription coactivator activity / transcription coactivator activity /  non-specific serine/threonine protein kinase / non-specific serine/threonine protein kinase /  cadherin binding / cadherin binding /  リン酸化 / リン酸化 /  mRNA binding / Neutrophil degranulation / magnesium ion binding / protein homodimerization activity / positive regulation of transcription by RNA polymerase II / mRNA binding / Neutrophil degranulation / magnesium ion binding / protein homodimerization activity / positive regulation of transcription by RNA polymerase II /  ミトコンドリア / ミトコンドリア /  RNA binding / extracellular exosome / extracellular region / RNA binding / extracellular exosome / extracellular region /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質類似検索 - 分子機能 細胞質類似検索 - 分子機能PK beta-barrel domain-like / M1 Pyruvate Kinase; Domain 3 /  Pyruvate kinase, C-terminal domain / Pyruvate kinase, C-terminal domain /  Pyruvate Kinase; Chain: A, domain 1 / Pyruvate Kinase; Chain: A, domain 1 /  Pyruvate kinase, active site / Pyruvate kinase active site signature. / Pyruvate kinase, active site / Pyruvate kinase active site signature. /  ピルビン酸キナーゼ / ピルビン酸キナーゼ /  Pyruvate kinase, barrel / Pyruvate kinase, barrel /  Pyruvate kinase, insert domain superfamily / Pyruvate kinase, insert domain superfamily /  Pyruvate kinase, barrel domain ...PK beta-barrel domain-like / M1 Pyruvate Kinase; Domain 3 / Pyruvate kinase, barrel domain ...PK beta-barrel domain-like / M1 Pyruvate Kinase; Domain 3 /  Pyruvate kinase, C-terminal domain / Pyruvate kinase, C-terminal domain /  Pyruvate Kinase; Chain: A, domain 1 / Pyruvate Kinase; Chain: A, domain 1 /  Pyruvate kinase, active site / Pyruvate kinase active site signature. / Pyruvate kinase, active site / Pyruvate kinase active site signature. /  ピルビン酸キナーゼ / ピルビン酸キナーゼ /  Pyruvate kinase, barrel / Pyruvate kinase, barrel /  Pyruvate kinase, insert domain superfamily / Pyruvate kinase, insert domain superfamily /  Pyruvate kinase, barrel domain / Pyruvate kinase, barrel domain /  Pyruvate kinase, C-terminal / Pyruvate kinase, C-terminal /  Pyruvate kinase, C-terminal domain superfamily / Pyruvate kinase, C-terminal domain superfamily /  Pyruvate kinase, alpha/beta domain / Pyruvate kinase-like, insert domain superfamily / Phosphoenolpyruvate-binding domains / Pyruvate kinase-like domain superfamily / Pyruvate/Phosphoenolpyruvate kinase-like domain superfamily / Pyruvate kinase, alpha/beta domain / Pyruvate kinase-like, insert domain superfamily / Phosphoenolpyruvate-binding domains / Pyruvate kinase-like domain superfamily / Pyruvate/Phosphoenolpyruvate kinase-like domain superfamily /  TIMバレル / Alpha-Beta Barrel / TIMバレル / Alpha-Beta Barrel /  Βバレル / 3-Layer(aba) Sandwich / Mainly Beta / Alpha Beta類似検索 - ドメイン・相同性 Βバレル / 3-Layer(aba) Sandwich / Mainly Beta / Alpha Beta類似検索 - ドメイン・相同性 Chem-DZG / 1,6-di-O-phosphono-beta-D-fructofuranose / L(+)-TARTARIC ACID / Pyruvate kinase PKM類似検索 - 構成要素 |
|---|
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.85 Å 分子置換 / 解像度: 1.85 Å |
|---|
 データ登録者 データ登録者 | Hong, B. / Dimov, S. / Tempel, W. / Auld, D. / Thomas, C. / Boxer, M. / Jianq, J.-K. / Skoumbourdis, A. / Min, S. / Southall, N. ...Hong, B. / Dimov, S. / Tempel, W. / Auld, D. / Thomas, C. / Boxer, M. / Jianq, J.-K. / Skoumbourdis, A. / Min, S. / Southall, N. / Arrowsmith, C.H. / Edwards, A.M. / Bountra, C. / Weigelt, J. / Bochkarev, A. / Inglese, J. / Park, H. / Structural Genomics Consortium (SGC) |
|---|
 引用 引用 |  ジャーナル: to be published ジャーナル: to be published
タイトル: Activator-Bound Structures of Human Pyruvate Kinase M2
著者: Hong, B. / Dimov, S. / Tempel, W. / Auld, D. / Thomas, C. / Boxer, M. / Jianq, J.-K. / Skoumbourdis, A. / Min, S. / Southall, N. / Arrowsmith, C.H. / Edwards, A.M. / Bountra, C. / Weigelt, J. ...著者: Hong, B. / Dimov, S. / Tempel, W. / Auld, D. / Thomas, C. / Boxer, M. / Jianq, J.-K. / Skoumbourdis, A. / Min, S. / Southall, N. / Arrowsmith, C.H. / Edwards, A.M. / Bountra, C. / Weigelt, J. / Bochkarev, A. / Inglese, J. / Park, H. |
|---|
| 履歴 | | 登録 | 2009年3月24日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2009年4月7日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2017年11月1日 | Group: Refinement description / カテゴリ: software |
|---|
| 改定 1.3 | 2020年7月29日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / diffrn_source ...chem_comp / diffrn_source / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _chem_comp.mon_nstd_flag / _chem_comp.name ..._chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _diffrn_source.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.4 | 2023年9月6日 | Group: Data collection / Database references ...Data collection / Database references / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード TRANSFERASE (転移酵素) / activator /
TRANSFERASE (転移酵素) / activator /  Acetylation (アセチル化) /
Acetylation (アセチル化) /  Allosteric enzyme /
Allosteric enzyme /  Alternative splicing (選択的スプライシング) /
Alternative splicing (選択的スプライシング) /  Glycolysis (解糖系) /
Glycolysis (解糖系) /  Kinase (キナーゼ) /
Kinase (キナーゼ) /  Magnesium (マグネシウム) / Metal-binding /
Magnesium (マグネシウム) / Metal-binding /  Phosphoprotein / Polymorphism /
Phosphoprotein / Polymorphism /  Pyruvate (ピルビン酸) /
Pyruvate (ピルビン酸) /  Structural Genomics (構造ゲノミクス) /
Structural Genomics (構造ゲノミクス) /  Structural Genomics Consortium / SGC
Structural Genomics Consortium / SGC 機能・相同性情報
機能・相同性情報 ピルビン酸キナーゼ /
ピルビン酸キナーゼ /  pyruvate kinase activity / positive regulation of cytoplasmic translation /
pyruvate kinase activity / positive regulation of cytoplasmic translation /  プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis /
プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis /  解糖系 / positive regulation of sprouting angiogenesis /
解糖系 / positive regulation of sprouting angiogenesis /  potassium ion binding /
potassium ion binding /  小胞体 ...
小胞体 ... ピルビン酸キナーゼ /
ピルビン酸キナーゼ /  pyruvate kinase activity / positive regulation of cytoplasmic translation /
pyruvate kinase activity / positive regulation of cytoplasmic translation /  プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis /
プログラム細胞死 / histone H3T11 kinase activity / canonical glycolysis /  解糖系 / positive regulation of sprouting angiogenesis /
解糖系 / positive regulation of sprouting angiogenesis /  potassium ion binding /
potassium ion binding /  小胞体 / glycolytic process /
小胞体 / glycolytic process /  non-specific protein-tyrosine kinase /
non-specific protein-tyrosine kinase /  繊毛 / cellular response to insulin stimulus /
繊毛 / cellular response to insulin stimulus /  extracellular vesicle / MHC class II protein complex binding /
extracellular vesicle / MHC class II protein complex binding /  protein tyrosine kinase activity / secretory granule lumen / collagen-containing extracellular matrix / vesicle / ficolin-1-rich granule lumen /
protein tyrosine kinase activity / secretory granule lumen / collagen-containing extracellular matrix / vesicle / ficolin-1-rich granule lumen /  transcription coactivator activity /
transcription coactivator activity /  non-specific serine/threonine protein kinase /
non-specific serine/threonine protein kinase /  cadherin binding /
cadherin binding /  リン酸化 /
リン酸化 /  mRNA binding / Neutrophil degranulation / magnesium ion binding / protein homodimerization activity / positive regulation of transcription by RNA polymerase II /
mRNA binding / Neutrophil degranulation / magnesium ion binding / protein homodimerization activity / positive regulation of transcription by RNA polymerase II /  ミトコンドリア /
ミトコンドリア /  RNA binding / extracellular exosome / extracellular region /
RNA binding / extracellular exosome / extracellular region /  ATP binding /
ATP binding /  細胞核 /
細胞核 /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 1.85 Å
分子置換 / 解像度: 1.85 Å  データ登録者
データ登録者 引用
引用 ジャーナル: to be published
ジャーナル: to be published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3gqy.cif.gz
3gqy.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3gqy.ent.gz
pdb3gqy.ent.gz PDB形式
PDB形式 3gqy.json.gz
3gqy.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/gq/3gqy
https://data.pdbj.org/pub/pdb/validation_reports/gq/3gqy ftp://data.pdbj.org/pub/pdb/validation_reports/gq/3gqy
ftp://data.pdbj.org/pub/pdb/validation_reports/gq/3gqy リンク
リンク 集合体
集合体
 要素
要素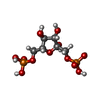


 Homo sapiens (ヒト) / 遺伝子: PKM2, PK2, PK3, PKM / プラスミド: pET28a-LIC / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PKM2, PK2, PK3, PKM / プラスミド: pET28a-LIC / 発現宿主: 
 Escherichia coli (大腸菌) / 株 (発現宿主): DE3 / 参照: UniProt: P14618,
Escherichia coli (大腸菌) / 株 (発現宿主): DE3 / 参照: UniProt: P14618,  ピルビン酸キナーゼ
ピルビン酸キナーゼ フルクトース-1,6-ビスリン酸
フルクトース-1,6-ビスリン酸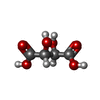





 酒石酸
酒石酸 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 回転陽極 / タイプ: RIGAKU FR-E / 波長: 1.5418 Å
回転陽極 / タイプ: RIGAKU FR-E / 波長: 1.5418 Å : 1.5418 Å / 相対比: 1
: 1.5418 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj







