+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3d9u | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | The BIR3 domain of cIAP1 in complex with the N terminal peptide from SMAC/DIABLO (AVPIAQ). | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  APOPTOSIS (アポトーシス) / APOPTOSIS (アポトーシス) /  zinc finger (ジンクフィンガー) / zinc finger (ジンクフィンガー) /  Cytoplasm (細胞質) / Metal-binding / Polymorphism / Cytoplasm (細胞質) / Metal-binding / Polymorphism /  Zinc (亜鉛) / Zinc (亜鉛) /  Zinc-finger (ジンクフィンガー) Zinc-finger (ジンクフィンガー) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of ripoptosome assembly involved in necroptotic process / regulation of cysteine-type endopeptidase activity / FBXO family protein binding / regulation of RIG-I signaling pathway / positive regulation of protein K48-linked ubiquitination / regulation of non-canonical NF-kappaB signal transduction / activation of cysteine-type endopeptidase activity involved in apoptotic process by cytochrome c / TNF receptor superfamily (TNFSF) members mediating non-canonical NF-kB pathway / regulation of necroptotic process / Release of apoptotic factors from the mitochondria ...negative regulation of ripoptosome assembly involved in necroptotic process / regulation of cysteine-type endopeptidase activity / FBXO family protein binding / regulation of RIG-I signaling pathway / positive regulation of protein K48-linked ubiquitination / regulation of non-canonical NF-kappaB signal transduction / activation of cysteine-type endopeptidase activity involved in apoptotic process by cytochrome c / TNF receptor superfamily (TNFSF) members mediating non-canonical NF-kB pathway / regulation of necroptotic process / Release of apoptotic factors from the mitochondria / regulation of nucleotide-binding domain, leucine rich repeat containing receptor signaling pathway / positive regulation of protein K63-linked ubiquitination / CD40 receptor complex / XY body / negative regulation of necroptotic process / SMAC, XIAP-regulated apoptotic response / Regulation of the apoptosome activity / SMAC (DIABLO) binds to IAPs / SMAC(DIABLO)-mediated dissociation of IAP:caspase complexes / regulation of reactive oxygen species metabolic process / positive regulation of protein monoubiquitination / TNFR1-induced proapoptotic signaling / RIPK1-mediated regulated necrosis / intrinsic apoptotic signaling pathway in response to oxidative stress /  regulation of toll-like receptor signaling pathway / regulation of toll-like receptor signaling pathway /  regulation of innate immune response / Apoptotic cleavage of cellular proteins / regulation of innate immune response / Apoptotic cleavage of cellular proteins /  regulation of cell differentiation / non-canonical NF-kappaB signal transduction / necroptotic process / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / extrinsic apoptotic signaling pathway via death domain receptors / canonical NF-kappaB signal transduction / response to cAMP / tumor necrosis factor-mediated signaling pathway / TICAM1, RIP1-mediated IKK complex recruitment / intrinsic apoptotic signaling pathway / IKK complex recruitment mediated by RIP1 / TNFR1-induced NF-kappa-B signaling pathway / regulation of cell differentiation / non-canonical NF-kappaB signal transduction / necroptotic process / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / extrinsic apoptotic signaling pathway via death domain receptors / canonical NF-kappaB signal transduction / response to cAMP / tumor necrosis factor-mediated signaling pathway / TICAM1, RIP1-mediated IKK complex recruitment / intrinsic apoptotic signaling pathway / IKK complex recruitment mediated by RIP1 / TNFR1-induced NF-kappa-B signaling pathway /  ubiquitin binding / positive regulation of protein ubiquitination / TNFR2 non-canonical NF-kB pathway / placenta development / Regulation of TNFR1 signaling / RING-type E3 ubiquitin transferase / NOD1/2 Signaling Pathway / ubiquitin binding / positive regulation of protein ubiquitination / TNFR2 non-canonical NF-kB pathway / placenta development / Regulation of TNFR1 signaling / RING-type E3 ubiquitin transferase / NOD1/2 Signaling Pathway /  ミトコンドリア / Regulation of necroptotic cell death / cytoplasmic side of plasma membrane / protein polyubiquitination / ubiquitin-protein transferase activity / activation of cysteine-type endopeptidase activity involved in apoptotic process / ミトコンドリア / Regulation of necroptotic cell death / cytoplasmic side of plasma membrane / protein polyubiquitination / ubiquitin-protein transferase activity / activation of cysteine-type endopeptidase activity involved in apoptotic process /  ubiquitin protein ligase activity / regulation of cell population proliferation / protein-folding chaperone binding / ubiquitin protein ligase activity / regulation of cell population proliferation / protein-folding chaperone binding /  regulation of inflammatory response / regulation of inflammatory response /  transferase activity / regulation of apoptotic process / proteasome-mediated ubiquitin-dependent protein catabolic process / neuron apoptotic process / positive regulation of canonical NF-kappaB signal transduction / response to ethanol / transferase activity / regulation of apoptotic process / proteasome-mediated ubiquitin-dependent protein catabolic process / neuron apoptotic process / positive regulation of canonical NF-kappaB signal transduction / response to ethanol /  transcription coactivator activity / cell surface receptor signaling pathway / response to hypoxia / Ub-specific processing proteases / transcription coactivator activity / cell surface receptor signaling pathway / response to hypoxia / Ub-specific processing proteases /  regulation of cell cycle / positive regulation of apoptotic process / apoptotic process / protein-containing complex binding / negative regulation of apoptotic process / regulation of cell cycle / positive regulation of apoptotic process / apoptotic process / protein-containing complex binding / negative regulation of apoptotic process /  ミトコンドリア / zinc ion binding / identical protein binding / ミトコンドリア / zinc ion binding / identical protein binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.3 Å 分子置換 / 解像度: 2.3 Å | ||||||
 データ登録者 データ登録者 | Kulathila, R. / Price, A. | ||||||
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.D / 年: 2009 ジャーナル: Acta Crystallogr.,Sect.D / 年: 2009タイトル: The structure of the BIR3 domain of cIAP1 in complex with the N-terminal peptides of SMAC and caspase-9. 著者: Kulathila, R. / Vash, B. / Sage, D. / Cornell-Kennon, S. / Wright, K. / Koehn, J. / Stams, T. / Clark, K. / Price, A. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3d9u.cif.gz 3d9u.cif.gz | 35.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3d9u.ent.gz pdb3d9u.ent.gz | 23.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3d9u.json.gz 3d9u.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d9/3d9u https://data.pdbj.org/pub/pdb/validation_reports/d9/3d9u ftp://data.pdbj.org/pub/pdb/validation_reports/d9/3d9u ftp://data.pdbj.org/pub/pdb/validation_reports/d9/3d9u | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 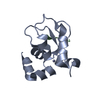
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| 単位格子 |
| |||||||||
| Components on special symmetry positions |
| |||||||||
| 詳細 | The biological unit is a heterodimeric complex of CIAP1-BIR3 with N-terminal peptide from SMAC/DIABLO (AVPIAQ). |
- 要素
要素
| #1: タンパク質 | 分子量: 11174.601 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: BIRC2, API1, IAP2, MIHB, RNF48 / プラスミド: pNAT40 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: BIRC2, API1, IAP2, MIHB, RNF48 / プラスミド: pNAT40 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): BL21 DE3 / 参照: UniProt: Q13490 Escherichia coli (大腸菌) / 株 (発現宿主): BL21 DE3 / 参照: UniProt: Q13490 |
|---|---|
| #2: タンパク質・ペプチド |  Diablo homolog Diablo homolog分子量: 597.703 Da / 分子数: 1 / 由来タイプ: 合成 詳細: peptide synthesized based on N-terminal fragment of SMAC/DIABLO (AVPIAQ). 参照: UniProt: Q9NR28*PLUS |
| #3: 化合物 | ChemComp-ZN / |
| #4: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.8 Å3/Da / 溶媒含有率: 56.15 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 6.5 詳細: 0.1 M BIS-TRIS PH 6.5, 0.2 M MGCL2, 22% PEG 3350, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU FR-E DW / 波長: 1.54 Å 回転陽極 / タイプ: RIGAKU FR-E DW / 波長: 1.54 Å |
| 検出器 | タイプ: RIGAKU RAXIS IV++ / 検出器: IMAGE PLATE / 日付: 2006年7月11日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.54 Å / 相対比: 1 : 1.54 Å / 相対比: 1 |
| 反射 | 解像度: 2.3→54.6 Å / Num. all: 6497 / Num. obs: 6193 / % possible obs: 95.4 % / Observed criterion σ(F): 1 / Observed criterion σ(I): 2 / 冗長度: 15.7 % / Biso Wilson estimate: 22.9 Å2 / Rmerge(I) obs: 0.191 / Net I/σ(I): 20.8 |
| 反射 シェル | 解像度: 2.3→2.38 Å / 冗長度: 15.6 % / Rmerge(I) obs: 0.876 / Mean I/σ(I) obs: 4 / Num. unique all: 607 / % possible all: 96.8 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: PDB entry 1NW9 解像度: 2.3→31.43 Å / Rfactor Rfree error: 0.01 / Data cutoff high absF: 309778.09 / Data cutoff low absF: 0 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber
| ||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 38.1086 Å2 / ksol: 0.357278 e/Å3 | ||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 31.3 Å2
| ||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.3→31.43 Å
| ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.3→2.44 Å / Rfactor Rfree error: 0.027 / Total num. of bins used: 6
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj













