| 登録情報 | データベース: PDB / ID: 2liu
|
|---|
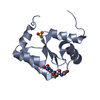
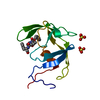
| タイトル | NMR structure of holo-ACPI domain from CurA module from Lyngbya majuscula |
|---|
 要素 要素 | CurA |
|---|
 キーワード キーワード |  TRANSFERASE (転移酵素) / Holo state TRANSFERASE (転移酵素) / Holo state |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
DIM/DIP cell wall layer assembly /  fatty acid synthase activity / secondary metabolite biosynthetic process / fatty acid synthase activity / secondary metabolite biosynthetic process /  phosphopantetheine binding / 3-oxoacyl-[acyl-carrier-protein] synthase activity / fatty acid biosynthetic process / identical protein binding / phosphopantetheine binding / 3-oxoacyl-[acyl-carrier-protein] synthase activity / fatty acid biosynthetic process / identical protein binding /  metal ion binding / metal ion binding /  細胞膜 / 細胞膜 /  細胞質類似検索 - 分子機能 細胞質類似検索 - 分子機能  フィタノイルCoAジオキシゲナーゼ / Phytanoyl-CoA dioxygenase (PhyH) / ACP-like / PKS_PP_betabranch / Malonyl-CoA ACP transacylase, ACP-binding / フィタノイルCoAジオキシゲナーゼ / Phytanoyl-CoA dioxygenase (PhyH) / ACP-like / PKS_PP_betabranch / Malonyl-CoA ACP transacylase, ACP-binding /  Polyketide synthase, C-terminal extension / Ketoacyl-synthetase C-terminal extension / Non-ribosomal Peptide Synthetase Peptidyl Carrier Protein; Chain A / Acyl transferase domain superfamily / Acyl transferase ... Polyketide synthase, C-terminal extension / Ketoacyl-synthetase C-terminal extension / Non-ribosomal Peptide Synthetase Peptidyl Carrier Protein; Chain A / Acyl transferase domain superfamily / Acyl transferase ... フィタノイルCoAジオキシゲナーゼ / Phytanoyl-CoA dioxygenase (PhyH) / ACP-like / PKS_PP_betabranch / Malonyl-CoA ACP transacylase, ACP-binding / フィタノイルCoAジオキシゲナーゼ / Phytanoyl-CoA dioxygenase (PhyH) / ACP-like / PKS_PP_betabranch / Malonyl-CoA ACP transacylase, ACP-binding /  Polyketide synthase, C-terminal extension / Ketoacyl-synthetase C-terminal extension / Non-ribosomal Peptide Synthetase Peptidyl Carrier Protein; Chain A / Acyl transferase domain superfamily / Acyl transferase / Acyl transferase domain / Acyl transferase domain in polyketide synthase (PKS) enzymes. / Acyl transferase/acyl hydrolase/lysophospholipase / Acetyltransferase (GNAT) family / Ketosynthase family 3 (KS3) domain profile. / Polyketide synthase, C-terminal extension / Ketoacyl-synthetase C-terminal extension / Non-ribosomal Peptide Synthetase Peptidyl Carrier Protein; Chain A / Acyl transferase domain superfamily / Acyl transferase / Acyl transferase domain / Acyl transferase domain in polyketide synthase (PKS) enzymes. / Acyl transferase/acyl hydrolase/lysophospholipase / Acetyltransferase (GNAT) family / Ketosynthase family 3 (KS3) domain profile. /  Polyketide synthase, phosphopantetheine-binding domain / Phosphopantetheine attachment site / Beta-ketoacyl synthase / Beta-ketoacyl synthase, active site / Ketosynthase family 3 (KS3) active site signature. / Polyketide synthase, phosphopantetheine-binding domain / Phosphopantetheine attachment site / Beta-ketoacyl synthase / Beta-ketoacyl synthase, active site / Ketosynthase family 3 (KS3) active site signature. /  Polyketide synthase, beta-ketoacyl synthase domain / Beta-ketoacyl synthase, N-terminal / Beta-ketoacyl synthase, C-terminal / Beta-ketoacyl synthase, N-terminal domain / Beta-ketoacyl synthase, C-terminal domain / Gcn5-related N-acetyltransferase (GNAT) domain profile. / Polyketide synthase, beta-ketoacyl synthase domain / Beta-ketoacyl synthase, N-terminal / Beta-ketoacyl synthase, C-terminal / Beta-ketoacyl synthase, N-terminal domain / Beta-ketoacyl synthase, C-terminal domain / Gcn5-related N-acetyltransferase (GNAT) domain profile. /  GNAT domain / Phosphopantetheine attachment site / Acyl-CoA N-acyltransferase / GNAT domain / Phosphopantetheine attachment site / Acyl-CoA N-acyltransferase /  Thiolase-like / Phosphopantetheine attachment site. / Phosphopantetheine attachment site / ACP-like superfamily / Carrier protein (CP) domain profile. / Phosphopantetheine binding ACP domain / Prokaryotic membrane lipoprotein lipid attachment site profile. / Winged helix DNA-binding domain superfamily / Winged helix-like DNA-binding domain superfamily / Orthogonal Bundle / Mainly Alpha類似検索 - ドメイン・相同性 Thiolase-like / Phosphopantetheine attachment site. / Phosphopantetheine attachment site / ACP-like superfamily / Carrier protein (CP) domain profile. / Phosphopantetheine binding ACP domain / Prokaryotic membrane lipoprotein lipid attachment site profile. / Winged helix DNA-binding domain superfamily / Winged helix-like DNA-binding domain superfamily / Orthogonal Bundle / Mainly Alpha類似検索 - ドメイン・相同性 |
|---|
| 生物種 |   Lyngbya majuscula (バクテリア) Lyngbya majuscula (バクテリア) |
|---|
| 手法 |  溶液NMR / torsion angle dynamics 溶液NMR / torsion angle dynamics |
|---|
| Model details | closest to the average, model 1 |
|---|
 データ登録者 データ登録者 | Busche, A.E. / Gottstein, D. / Hein, C. / Ripin, N. / Pader, I. / Tufar, P. / Eisman, E.B. / Gu, L. / Walsh, C.T. / Loehr, F. ...Busche, A.E. / Gottstein, D. / Hein, C. / Ripin, N. / Pader, I. / Tufar, P. / Eisman, E.B. / Gu, L. / Walsh, C.T. / Loehr, F. / Sherman, D.H. / Guntert, P. / Dotsch, V. |
|---|
 引用 引用 |  ジャーナル: Acs Chem.Biol. / 年: 2012 ジャーナル: Acs Chem.Biol. / 年: 2012
タイトル: Characterization of Molecular Interactions between ACP and Halogenase Domains in the Curacin A Polyketide Synthase.
著者: Busche, A. / Gottstein, D. / Hein, C. / Ripin, N. / Pader, I. / Tufar, P. / Eisman, E.B. / Gu, L. / Walsh, C.T. / Sherman, D.H. / Lohr, F. / Guntert, P. / Dotsch, V. |
|---|
| 履歴 | | 登録 | 2011年9月1日 | 登録サイト: BMRB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2011年12月14日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年12月21日 | Group: Structure summary |
|---|
| 改定 1.2 | 2012年3月14日 | Group: Database references |
|---|
| 改定 1.3 | 2023年6月14日 | Group: Data collection / Database references / Other
カテゴリ: database_2 / pdbx_database_status ...database_2 / pdbx_database_status / pdbx_nmr_spectrometer / struct_ref_seq_dif
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_nmr_data / _pdbx_nmr_spectrometer.model / _struct_ref_seq_dif.details |
|---|
| 改定 1.4 | 2024年5月15日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2 / Item: _database_2.pdbx_DOI |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード TRANSFERASE (転移酵素) / Holo state
TRANSFERASE (転移酵素) / Holo state 機能・相同性情報
機能・相同性情報 fatty acid synthase activity / secondary metabolite biosynthetic process /
fatty acid synthase activity / secondary metabolite biosynthetic process /  phosphopantetheine binding / 3-oxoacyl-[acyl-carrier-protein] synthase activity / fatty acid biosynthetic process / identical protein binding /
phosphopantetheine binding / 3-oxoacyl-[acyl-carrier-protein] synthase activity / fatty acid biosynthetic process / identical protein binding /  metal ion binding /
metal ion binding /  細胞膜 /
細胞膜 /  細胞質
細胞質
 Lyngbya majuscula (バクテリア)
Lyngbya majuscula (バクテリア) 溶液NMR / torsion angle dynamics
溶液NMR / torsion angle dynamics  データ登録者
データ登録者 引用
引用 ジャーナル: Acs Chem.Biol. / 年: 2012
ジャーナル: Acs Chem.Biol. / 年: 2012 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2liu.cif.gz
2liu.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2liu.ent.gz
pdb2liu.ent.gz PDB形式
PDB形式 2liu.json.gz
2liu.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/li/2liu
https://data.pdbj.org/pub/pdb/validation_reports/li/2liu ftp://data.pdbj.org/pub/pdb/validation_reports/li/2liu
ftp://data.pdbj.org/pub/pdb/validation_reports/li/2liu リンク
リンク 集合体
集合体
 要素
要素
 Lyngbya majuscula (バクテリア) / 遺伝子: curA / 発現宿主:
Lyngbya majuscula (バクテリア) / 遺伝子: curA / 発現宿主: 
 Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: Q6DNF2
Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: Q6DNF2 溶液NMR
溶液NMR 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj









