+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1s4g | ||||||
|---|---|---|---|---|---|---|---|
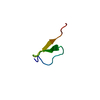
| タイトル | Somatomedin-B Domain of human plasma vitronectin. | ||||||
 要素 要素 | Vitronectin ビトロネクチン ビトロネクチン | ||||||
 キーワード キーワード |  CELL ADHESION (細胞接着) / CELL ADHESION (細胞接着) /  Somatomedin B domain / disulfide knot / Somatomedin B domain / disulfide knot /  vitronectin (ビトロネクチン) vitronectin (ビトロネクチン) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報rough endoplasmic reticulum lumen / smooth muscle cell-matrix adhesion /  peptidase inhibitor complex / alphav-beta3 integrin-vitronectin complex / scavenger receptor activity / negative regulation of endopeptidase activity / protein complex involved in cell-matrix adhesion / negative regulation of blood coagulation / peptidase inhibitor complex / alphav-beta3 integrin-vitronectin complex / scavenger receptor activity / negative regulation of endopeptidase activity / protein complex involved in cell-matrix adhesion / negative regulation of blood coagulation /  extracellular matrix binding / positive regulation of vascular endothelial growth factor receptor signaling pathway ...rough endoplasmic reticulum lumen / smooth muscle cell-matrix adhesion / extracellular matrix binding / positive regulation of vascular endothelial growth factor receptor signaling pathway ...rough endoplasmic reticulum lumen / smooth muscle cell-matrix adhesion /  peptidase inhibitor complex / alphav-beta3 integrin-vitronectin complex / scavenger receptor activity / negative regulation of endopeptidase activity / protein complex involved in cell-matrix adhesion / negative regulation of blood coagulation / peptidase inhibitor complex / alphav-beta3 integrin-vitronectin complex / scavenger receptor activity / negative regulation of endopeptidase activity / protein complex involved in cell-matrix adhesion / negative regulation of blood coagulation /  extracellular matrix binding / positive regulation of vascular endothelial growth factor receptor signaling pathway / positive regulation of cell-substrate adhesion / Molecules associated with elastic fibres / extracellular matrix structural constituent / cell adhesion mediated by integrin / Syndecan interactions / extracellular matrix binding / positive regulation of vascular endothelial growth factor receptor signaling pathway / positive regulation of cell-substrate adhesion / Molecules associated with elastic fibres / extracellular matrix structural constituent / cell adhesion mediated by integrin / Syndecan interactions /  polysaccharide binding / positive regulation of wound healing / positive regulation of smooth muscle cell migration / endodermal cell differentiation / oligodendrocyte differentiation / protein polymerization / polysaccharide binding / positive regulation of wound healing / positive regulation of smooth muscle cell migration / endodermal cell differentiation / oligodendrocyte differentiation / protein polymerization /  基底膜 / ECM proteoglycans / Integrin cell surface interactions / negative regulation of fibrinolysis / 基底膜 / ECM proteoglycans / Integrin cell surface interactions / negative regulation of fibrinolysis /  regulation of cell adhesion / regulation of cell adhesion /  collagen binding / extracellular matrix organization / cell-matrix adhesion / collagen binding / extracellular matrix organization / cell-matrix adhesion /  Regulation of Complement cascade / Regulation of Complement cascade /  liver regeneration / positive regulation of receptor-mediated endocytosis / Golgi lumen / positive regulation of peptidyl-tyrosine phosphorylation / liver regeneration / positive regulation of receptor-mediated endocytosis / Golgi lumen / positive regulation of peptidyl-tyrosine phosphorylation /  遊走 / 遊走 /  integrin binding / positive regulation of protein binding / integrin binding / positive regulation of protein binding /  heparin binding / collagen-containing extracellular matrix / blood microparticle / heparin binding / collagen-containing extracellular matrix / blood microparticle /  細胞接着 / 細胞接着 /  免疫応答 / intracellular membrane-bounded organelle / 免疫応答 / intracellular membrane-bounded organelle /  小胞体 / 小胞体 /  extracellular space / extracellular exosome / extracellular region / identical protein binding extracellular space / extracellular exosome / extracellular region / identical protein binding類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  溶液NMR / 溶液NMR /  simulated annealing simulated annealing | ||||||
 データ登録者 データ登録者 | Mayasundari, A. / Whittemore, N.A. / Serpersu, E.H. / Peterson, C.B. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2004 ジャーナル: J.Biol.Chem. / 年: 2004タイトル: The solution structure of the N-terminal domain of human vitronectin: proximal sites that regulate fibrinolysis and cell migration 著者: Mayasundari, A. / Whittemore, N.A. / Serpersu, E.H. / Peterson, C.B. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1s4g.cif.gz 1s4g.cif.gz | 297 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1s4g.ent.gz pdb1s4g.ent.gz | 255.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1s4g.json.gz 1s4g.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/s4/1s4g https://data.pdbj.org/pub/pdb/validation_reports/s4/1s4g ftp://data.pdbj.org/pub/pdb/validation_reports/s4/1s4g ftp://data.pdbj.org/pub/pdb/validation_reports/s4/1s4g | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 |  ビトロネクチン ビトロネクチン分子量: 5824.493 Da / 分子数: 1 / 断片: Somatomedin B / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 組織: plasma / 参照: UniProt: P04004 Homo sapiens (ヒト) / 組織: plasma / 参照: UniProt: P04004 |
|---|---|
| #2: 化合物 | ChemComp-OH /  Hydroxide Hydroxide |
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 | 内容: Isolated from human plasma vitronectin by CNBr cleavage |
|---|---|
| 試料状態 | イオン強度: low / pH: 4.4 / 温度: 298 K |
-NMR測定
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M |
|---|---|
| 放射波長 | 相対比: 1 |
| NMRスペクトロメーター | タイプ: Varian INOVA / 製造業者: Varian / モデル : INOVA / 磁場強度: 600 MHz : INOVA / 磁場強度: 600 MHz |
- 解析
解析
| NMR software |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法:  simulated annealing / ソフトェア番号: 1 simulated annealing / ソフトェア番号: 1 詳細: NOE cross-peak intensities were converted into distance restraints as follows: strong, 1.8-2.7 ; medium, 1.8-3.4 ; weak, 1.8-4.5 , and very weak 1.8-6.0. An additional 1.0 was added to upper ...詳細: NOE cross-peak intensities were converted into distance restraints as follows: strong, 1.8-2.7 ; medium, 1.8-3.4 ; weak, 1.8-4.5 , and very weak 1.8-6.0. An additional 1.0 was added to upper limits involving methyl protons, 0.5 for methylene protons and 2.3 for degenerate Hd and He protons of tyrosines and phenylalanines. Also, a 0.2 was added to the upper limits of NOEs involving amide protons. Backbone F angles were restrained to -120 50 for 3JHNHa = 8-9 Hz, and -120 40 for JHNHa > 9Hz. A restraint of 100 80 was also applied to F angle for residues that show stronger NHi-Hai-1 NOE than the intraresidue NH-Ha NOE. A total of 329 NOE restraints and 18 F restraints were used in structure determination. Random structures were generated by subjecting the peptide to an initial 10000-step minimization at 298K. The temperature was then raised gradually to 1000K during a 1000 step dynamics simulation. The peptide was subjected to minimization and a 10ps dynamics at 1000K. The NMR-derived restraints were then imposed on the peptide and the peptide was slowly annealed to 298K in a 100ps trajectory. Finally, the structures were subjected to further minimization at 298K. The force constant for the distance restraints was 100 kcal/mol 2 and the dielectric constant was 4. | ||||||||||||||||||||||||||||
| 代表構造 | 選択基準: closest to the average | ||||||||||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with favorable non-bond energy 計算したコンフォーマーの数: 60 / 登録したコンフォーマーの数: 20 |
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj