登録情報 データベース : PDB / ID : 1kdgタイトル Crystal structure of the flavin domain of cellobiose dehydrogenase cellobiose dehydrogenase キーワード / / / / / 機能・相同性 生物種 Phanerochaete chrysosporium (菌類)手法 / / / 解像度 : 1.5 Å データ登録者 Hallberg, B.M. / Henriksson, G. / Pettersson, G. / Divne, C. ジャーナル : J.Mol.Biol. / 年 : 2002タイトル : Crystal Structure of the Flavoprotein Domain of the Extracellular Flavocytochrome Cellobiose Dehydrogenase著者 : Hallberg, B.M. / Henriksson, G. / Pettersson, G. / Divne, C. 履歴 登録 2001年11月13日 登録サイト / 処理サイト 改定 1.0 2002年11月13日 Provider / タイプ 改定 1.1 2008年4月27日 Group 改定 1.2 2011年7月13日 Group / Version format compliance改定 1.3 2012年5月9日 Group 改定 1.4 2018年3月7日 Group / Data collection / カテゴリ / pdbx_unobs_or_zero_occ_atoms / Item 改定 1.5 2020年7月29日 Group / Derived calculations / Structure summaryカテゴリ chem_comp / entity ... chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / pdbx_struct_conn_angle / struct_conn / struct_site / struct_site_gen Item _chem_comp.name / _chem_comp.type ... _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr1_symmetry / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_conn.ptnr2_symmetry 解説 / Provider / タイプ
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 セロビオースデヒドロゲナーゼ (受容体)
セロビオースデヒドロゲナーゼ (受容体)  キーワード
キーワード OXIDOREDUCTASE (酸化還元酵素) / GMC oxidoreductase / PHBH fold / alpha/beta structure /
OXIDOREDUCTASE (酸化還元酵素) / GMC oxidoreductase / PHBH fold / alpha/beta structure /  Rossmann fold (ロスマンフォールド) / 6-hydroxylated FAD
Rossmann fold (ロスマンフォールド) / 6-hydroxylated FAD 機能・相同性情報
機能・相同性情報 セロビオースデヒドロゲナーゼ (受容体) /
セロビオースデヒドロゲナーゼ (受容体) /  cellobiose dehydrogenase (acceptor) activity / oxidoreductase activity, acting on paired donors, with incorporation or reduction of molecular oxygen / cellulose catabolic process /
cellobiose dehydrogenase (acceptor) activity / oxidoreductase activity, acting on paired donors, with incorporation or reduction of molecular oxygen / cellulose catabolic process /  flavin adenine dinucleotide binding / extracellular region /
flavin adenine dinucleotide binding / extracellular region /  metal ion binding
metal ion binding
 Phanerochaete chrysosporium (菌類)
Phanerochaete chrysosporium (菌類) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  多波長異常分散 / 解像度: 1.5 Å
多波長異常分散 / 解像度: 1.5 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Mol.Biol. / 年: 2002
ジャーナル: J.Mol.Biol. / 年: 2002 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1kdg.cif.gz
1kdg.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1kdg.ent.gz
pdb1kdg.ent.gz PDB形式
PDB形式 1kdg.json.gz
1kdg.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/kd/1kdg
https://data.pdbj.org/pub/pdb/validation_reports/kd/1kdg ftp://data.pdbj.org/pub/pdb/validation_reports/kd/1kdg
ftp://data.pdbj.org/pub/pdb/validation_reports/kd/1kdg リンク
リンク 集合体
集合体

 要素
要素 セロビオースデヒドロゲナーゼ (受容体) / E.C.1.1.3.25, E.C.1.1.5.1 / CDH / CELLOBIOSE-QUINONE OXIDOREDUCTASE /
セロビオースデヒドロゲナーゼ (受容体) / E.C.1.1.3.25, E.C.1.1.5.1 / CDH / CELLOBIOSE-QUINONE OXIDOREDUCTASE / 
 Phanerochaete chrysosporium (菌類) / 株: K3
Phanerochaete chrysosporium (菌類) / 株: K3 セロビオースデヒドロゲナーゼ (受容体)
セロビオースデヒドロゲナーゼ (受容体)


 N-アセチルグルコサミン
N-アセチルグルコサミン マンノース
マンノース
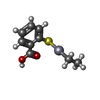






 水銀
水銀 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  MAX II
MAX II  / ビームライン: I711 / 波長: 0.996 Å
/ ビームライン: I711 / 波長: 0.996 Å : 0.996 Å / 相対比: 1
: 0.996 Å / 相対比: 1  解析
解析 :
:  多波長異常分散 / 解像度: 1.5→23 Å / Isotropic thermal model: anisotropic / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
多波長異常分散 / 解像度: 1.5→23 Å / Isotropic thermal model: anisotropic / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber : 0.134
: 0.134  ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj























