+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-7544 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human CLC-1 chloride ion channel, transmembrane domain | |||||||||
 マップデータ マップデータ | Summed map, filtered and sharpened | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  chloride (塩化物) / channel / CLC / chloride (塩化物) / channel / CLC /  TRANSPORT PROTEIN (運搬体タンパク質) TRANSPORT PROTEIN (運搬体タンパク質) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報voltage-gated chloride channel activity / neuronal action potential propagation / chloride transport /  chloride channel complex / chloride transmembrane transport / chloride channel complex / chloride transmembrane transport /  muscle contraction / muscle contraction /  筋鞘 / Stimuli-sensing channels / protein homodimerization activity / 筋鞘 / Stimuli-sensing channels / protein homodimerization activity /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.36 Å クライオ電子顕微鏡法 / 解像度: 3.36 Å | |||||||||
 データ登録者 データ登録者 | Park E / MacKinnon R | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2018 ジャーナル: Elife / 年: 2018タイトル: Structure of the CLC-1 chloride channel from . 著者: Eunyong Park / Roderick MacKinnon /  要旨: CLC channels mediate passive Cl conduction, while CLC transporters mediate active Cl transport coupled to H transport in the opposite direction. The distinction between CLC-0/1/2 channels and CLC ...CLC channels mediate passive Cl conduction, while CLC transporters mediate active Cl transport coupled to H transport in the opposite direction. The distinction between CLC-0/1/2 channels and CLC transporters seems undetectable by amino acid sequence. To understand why they are different functionally we determined the structure of the human CLC-1 channel. Its 'glutamate gate' residue, known to mediate proton transfer in CLC transporters, adopts a location in the structure that appears to preclude it from its transport function. Furthermore, smaller side chains produce a wider pore near the intracellular surface, potentially reducing a kinetic barrier for Cl conduction. When the corresponding residues are mutated in a transporter, it is converted to a channel. Finally, Cl at key sites in the pore appear to interact with reduced affinity compared to transporters. Thus, subtle differences in glutamate gate conformation, internal pore diameter and Cl affinity distinguish CLC channels and transporters. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_7544.map.gz emd_7544.map.gz | 117.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-7544-v30.xml emd-7544-v30.xml emd-7544.xml emd-7544.xml | 15.2 KB 15.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_7544_fsc.xml emd_7544_fsc.xml | 11.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_7544.png emd_7544.png | 131.6 KB | ||
| Filedesc metadata |  emd-7544.cif.gz emd-7544.cif.gz | 5.6 KB | ||
| その他 |  emd_7544_half_map_1.map.gz emd_7544_half_map_1.map.gz emd_7544_half_map_2.map.gz emd_7544_half_map_2.map.gz | 96.9 MB 96.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-7544 http://ftp.pdbj.org/pub/emdb/structures/EMD-7544 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-7544 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-7544 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_7544.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_7544.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Summed map, filtered and sharpened | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.03 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: Half map 1, unfiltered
| ファイル | emd_7544_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1, unfiltered | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
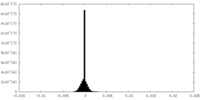
| 密度ヒストグラム |
-ハーフマップ: Half map 2, unfiltered
| ファイル | emd_7544_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2, unfiltered | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
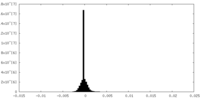
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human CLC-1 chloride ion channel
| 全体 | 名称: Human CLC-1 chloride ion channel |
|---|---|
| 要素 |
|
-超分子 #1: Human CLC-1 chloride ion channel
| 超分子 | 名称: Human CLC-1 chloride ion channel / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Chloride channel protein 1
| 分子 | 名称: Chloride channel protein 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 108.733172 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MEQSRSQQRG GEQSWWGSDP QYQYMPFEHC TSYGLPSENG GLQHRLRKDA GPRHNVHPTQ IYGHHKEQFS DREQDIGMPK KTGSSSTVD SKDEDHYSKC QDCIHRLGQV VRRKLGEDGI FLVLLGLLMA LVSWSMDYVS AKSLQAYKWS YAQMQPSLPL Q FLVWVTFP ...文字列: MEQSRSQQRG GEQSWWGSDP QYQYMPFEHC TSYGLPSENG GLQHRLRKDA GPRHNVHPTQ IYGHHKEQFS DREQDIGMPK KTGSSSTVD SKDEDHYSKC QDCIHRLGQV VRRKLGEDGI FLVLLGLLMA LVSWSMDYVS AKSLQAYKWS YAQMQPSLPL Q FLVWVTFP LVLILFSALF CHLISPQAVG SGIPEMKTIL RGVVLKEYLT MKAFVAKVVA LTAGLGSGIP VGKEGPFVHI AS ICAAVLS KFMSVFCGVY EQPYYYSDIL TVGCAVGVGC CFGTPLGGVL FSIEVTSTYF AVRNYWRGFF AATFSAFVFR VLA VWNKDA VTITALFRTN FRMDFPFDLK ELPAFAAIGI CCGLLGAVFV YLHRQVMLGV RKHKALSQFL AKHRLLYPGI VTFV IASFT FPPGMGQFMA GELMPREAIS TLFDNNTWVK HAGDPESLGQ SAVWIHPRVN VVIIIFLFFV MKFWMSIVAT TMPIP CGGF MPVFVLGAAF GRLVGEIMAM LFPDGILFDD IIYKILPGGY AVIGAAALTG AVSHTVSTAV ICFELTGQIA HILPMM VAV ILANMVAQSL QPSLYDSIIQ VKKLPYLPDL GWNQLSKYTI FVEDIMVRDV KFVSASYTYG ELRTLLQTTT VKTLPLV DS KDSMILLGSV ERSELQALLQ RHLCPERRLR AAQEMARKLS ELPYDGKARL AGEGLPGAPP GRPESFAFVD EDEDEDLS G KSELPPSLAL HPSTTAPLSP EEPNGPLPGH KQQPEAPEPA GQRPSIFQSL LHCLLGRARP TKKKTTQDST DLVDNMSPE EIEAWEQEQL SQPVCFDSCC IDQSPFQLVE QTTLHKTHTL FSLLGLHLAY VTSMGKLRGV LALEELQKAI EGHTKSGVQL RPPLASFRN TTSTRKSTGA PPSSAENWNL PEDRPGATGT GDVIAASPET PVPSPSPEPP LSLAPGKVEG ELEELELVES P GLEEELAD ILQGPSLRST DEEDEDELIL UniProtKB:  Chloride channel protein 1 Chloride channel protein 1 |
-分子 #2: CHLORIDE ION
| 分子 | 名称: CHLORIDE ION / タイプ: ligand / ID: 2 / コピー数: 4 / 式: CL |
|---|---|
| 分子量 | 理論値: 35.453 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 39.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: OTHER |
|---|---|
| 得られたモデル |  PDB-6coy: |
 ムービー
ムービー コントローラー
コントローラー

















 Z
Z Y
Y X
X