+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human RAD52 protein | ||||||||||||||||||||||||
 マップデータ マップデータ | |||||||||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報double-strand break repair via single-strand annealing / DNA double-strand break processing involved in repair via single-strand annealing / DNA recombinase assembly / regulation of nucleotide-excision repair /  mitotic recombination / HDR through MMEJ (alt-NHEJ) / HDR through Single Strand Annealing (SSA) / SUMOylation of DNA damage response and repair proteins / mitotic recombination / HDR through MMEJ (alt-NHEJ) / HDR through Single Strand Annealing (SSA) / SUMOylation of DNA damage response and repair proteins /  デオキシリボ核酸 / double-strand break repair via homologous recombination ...double-strand break repair via single-strand annealing / DNA double-strand break processing involved in repair via single-strand annealing / DNA recombinase assembly / regulation of nucleotide-excision repair / デオキシリボ核酸 / double-strand break repair via homologous recombination ...double-strand break repair via single-strand annealing / DNA double-strand break processing involved in repair via single-strand annealing / DNA recombinase assembly / regulation of nucleotide-excision repair /  mitotic recombination / HDR through MMEJ (alt-NHEJ) / HDR through Single Strand Annealing (SSA) / SUMOylation of DNA damage response and repair proteins / mitotic recombination / HDR through MMEJ (alt-NHEJ) / HDR through Single Strand Annealing (SSA) / SUMOylation of DNA damage response and repair proteins /  デオキシリボ核酸 / double-strand break repair via homologous recombination / double-strand break repair / cellular response to oxidative stress / デオキシリボ核酸 / double-strand break repair via homologous recombination / double-strand break repair / cellular response to oxidative stress /  single-stranded DNA binding / DNA recombination / protein-containing complex / single-stranded DNA binding / DNA recombination / protein-containing complex /  DNA binding / DNA binding /  核質 / identical protein binding / 核質 / identical protein binding /  細胞核 細胞核類似検索 - 分子機能 | ||||||||||||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||
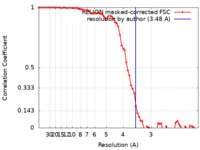
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.48 Å クライオ電子顕微鏡法 / 解像度: 3.48 Å | ||||||||||||||||||||||||
 データ登録者 データ登録者 | Kinoshita C / Takizawa Y / Saotome M / Ogino S / Kurumizaka H / Kagawa W | ||||||||||||||||||||||||
| 資金援助 |  日本, 7件 日本, 7件
| ||||||||||||||||||||||||
 引用 引用 |  ジャーナル: FEBS Open Bio / 年: 2023 ジャーナル: FEBS Open Bio / 年: 2023タイトル: The cryo-EM structure of full-length RAD52 protein contains an undecameric ring. 著者: Chiaki Kinoshita / Yoshimasa Takizawa / Mika Saotome / Shun Ogino / Hitoshi Kurumizaka / Wataru Kagawa /  要旨: The human RAD52 protein, which forms an oligomeric ring structure, is involved in DNA double-strand break repair. The N-terminal half of RAD52 is primarily responsible for self-oligomerisation and ...The human RAD52 protein, which forms an oligomeric ring structure, is involved in DNA double-strand break repair. The N-terminal half of RAD52 is primarily responsible for self-oligomerisation and DNA binding. Crystallographic studies have revealed the detailed structure of the N-terminal half. However, only low-resolution structures have been reported for the full-length protein, and thus the structural role of the C-terminal half in self-oligomerisation has remained elusive. In this study, we determined the solution structure of the human RAD52 protein by cryo-electron microscopy (cryo-EM), at an average resolution of 3.5 Å. The structure revealed an undecameric ring that is nearly identical to the crystal structures of the N-terminal half. The cryo-EM map for the C-terminal half was poorly defined, indicating that the region is intrinsically disordered. The present cryo-EM structure provides important insights into the mechanistic roles played by the N-terminal and C-terminal halves of RAD52 during DNA double-strand break repair. | ||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34430.map.gz emd_34430.map.gz | 2.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34430-v30.xml emd-34430-v30.xml emd-34430.xml emd-34430.xml | 18 KB 18 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_34430_fsc.xml emd_34430_fsc.xml | 7.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_34430.png emd_34430.png | 231.2 KB | ||
| その他 |  emd_34430_half_map_1.map.gz emd_34430_half_map_1.map.gz emd_34430_half_map_2.map.gz emd_34430_half_map_2.map.gz | 23.5 MB 23.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34430 http://ftp.pdbj.org/pub/emdb/structures/EMD-34430 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34430 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34430 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8h1pMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34430.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34430.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_34430_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_34430_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RAD52
| 全体 | 名称: RAD52 |
|---|---|
| 要素 |
|
-超分子 #1: RAD52
| 超分子 | 名称: RAD52 / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: DNA repair protein RAD52 homolog
| 分子 | 名称: DNA repair protein RAD52 homolog / タイプ: protein_or_peptide / ID: 1 / コピー数: 11 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 46.514934 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: GSHMSGTEEA ILGGRDSHPA AGGGSVLCFG QCQYTAEEYQ AIQKALRQRL GPEYISSRMA GGGQKVCYIE GHRVINLANE MFGYNGWAH SITQQNVDFV DLNNGKFYVG VCAFVRVQLK DGSYHEDVGY GVSEGLKSKA LSLEKARKEA VTDGLKRALR S FGNALGNC ...文字列: GSHMSGTEEA ILGGRDSHPA AGGGSVLCFG QCQYTAEEYQ AIQKALRQRL GPEYISSRMA GGGQKVCYIE GHRVINLANE MFGYNGWAH SITQQNVDFV DLNNGKFYVG VCAFVRVQLK DGSYHEDVGY GVSEGLKSKA LSLEKARKEA VTDGLKRALR S FGNALGNC ILDKDYLRSL NKLPRQLPLE VDLTKAKRQD LEPSVEEARY NSCRPNMALG HPQLQQVTSP SRPSHAVIPA DQ DCSSRSL SSSAVESEAT HQRKLRQKQL QQQFRERMEK QQVRVSTPSA EKSEAAPPAP PVTHSTPVTV SEPLLEKDFL AGV TQELIK TLEDNSEKWA VTPDAGDGVV KPSSRADPAQ TSDTLALNNQ MVTQNRTPHS VCHQKPQAKS GSWDLQTYSA DQRT TGNWE SHRKSQDMKK RKYDPS |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 57.6 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z
Z Y
Y X
X