+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human L-TGF-beta1 in complex with the anchor protein LRRC33 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / sequestering of TGFbeta in extracellular matrix / adaptive immune response based on somatic recombination of immune receptors built from immunoglobulin superfamily domains / positive regulation of microglia differentiation / regulation of interleukin-23 production / branch elongation involved in mammary gland duct branching / Influenza Virus Induced Apoptosis / regulation of branching involved in mammary gland duct morphogenesis / frontal suture morphogenesis / negative regulation of skeletal muscle tissue development ...: / sequestering of TGFbeta in extracellular matrix / adaptive immune response based on somatic recombination of immune receptors built from immunoglobulin superfamily domains / positive regulation of microglia differentiation / regulation of interleukin-23 production / branch elongation involved in mammary gland duct branching / Influenza Virus Induced Apoptosis / regulation of branching involved in mammary gland duct morphogenesis / frontal suture morphogenesis / negative regulation of skeletal muscle tissue development / TGFBR2 MSI Frameshift Mutants in Cancer / regulation of enamel mineralization / regulatory T cell differentiation / regulation of cartilage development / regulation of blood vessel remodeling / regulation of striated muscle tissue development / tolerance induction to self antigen / negative regulation of natural killer cell mediated cytotoxicity directed against tumor cell target / regulation of protein import into nucleus /  extracellular matrix assembly / embryonic liver development / columnar/cuboidal epithelial cell maturation / type III transforming growth factor beta receptor binding / negative regulation of hyaluronan biosynthetic process / Langerhans cell differentiation / positive regulation of odontogenesis / positive regulation of cardiac muscle cell differentiation / myofibroblast differentiation / connective tissue replacement involved in inflammatory response wound healing / positive regulation of exit from mitosis / negative regulation of macrophage cytokine production / positive regulation of receptor signaling pathway via STAT / odontoblast differentiation / TGFBR2 Kinase Domain Mutants in Cancer / positive regulation of smooth muscle cell differentiation / positive regulation of mesenchymal stem cell proliferation / positive regulation of isotype switching to IgA isotypes / positive regulation of primary miRNA processing / mammary gland branching involved in thelarche / extracellular matrix assembly / embryonic liver development / columnar/cuboidal epithelial cell maturation / type III transforming growth factor beta receptor binding / negative regulation of hyaluronan biosynthetic process / Langerhans cell differentiation / positive regulation of odontogenesis / positive regulation of cardiac muscle cell differentiation / myofibroblast differentiation / connective tissue replacement involved in inflammatory response wound healing / positive regulation of exit from mitosis / negative regulation of macrophage cytokine production / positive regulation of receptor signaling pathway via STAT / odontoblast differentiation / TGFBR2 Kinase Domain Mutants in Cancer / positive regulation of smooth muscle cell differentiation / positive regulation of mesenchymal stem cell proliferation / positive regulation of isotype switching to IgA isotypes / positive regulation of primary miRNA processing / mammary gland branching involved in thelarche /  membrane protein intracellular domain proteolysis / SMAD2/3 Phosphorylation Motif Mutants in Cancer / TGFBR1 KD Mutants in Cancer / heart valve morphogenesis / response to laminar fluid shear stress / retina vasculature development in camera-type eye / positive regulation of vasculature development / hyaluronan catabolic process / bronchiole development / regulation of transforming growth factor beta receptor signaling pathway / ATP biosynthetic process / receptor catabolic process / positive regulation of branching involved in ureteric bud morphogenesis / negative regulation of extracellular matrix disassembly / positive regulation of extracellular matrix assembly / lens fiber cell differentiation / response to salt / type II transforming growth factor beta receptor binding / TGFBR1 LBD Mutants in Cancer / oligodendrocyte development / germ cell migration / negative regulation of biomineral tissue development / type I transforming growth factor beta receptor binding / positive regulation of chemotaxis / phospholipid homeostasis / endoderm development / negative regulation of myoblast differentiation / positive regulation of mononuclear cell migration / cell-cell junction organization / response to vitamin D / positive regulation of vascular permeability / positive regulation of regulatory T cell differentiation / membrane protein intracellular domain proteolysis / SMAD2/3 Phosphorylation Motif Mutants in Cancer / TGFBR1 KD Mutants in Cancer / heart valve morphogenesis / response to laminar fluid shear stress / retina vasculature development in camera-type eye / positive regulation of vasculature development / hyaluronan catabolic process / bronchiole development / regulation of transforming growth factor beta receptor signaling pathway / ATP biosynthetic process / receptor catabolic process / positive regulation of branching involved in ureteric bud morphogenesis / negative regulation of extracellular matrix disassembly / positive regulation of extracellular matrix assembly / lens fiber cell differentiation / response to salt / type II transforming growth factor beta receptor binding / TGFBR1 LBD Mutants in Cancer / oligodendrocyte development / germ cell migration / negative regulation of biomineral tissue development / type I transforming growth factor beta receptor binding / positive regulation of chemotaxis / phospholipid homeostasis / endoderm development / negative regulation of myoblast differentiation / positive regulation of mononuclear cell migration / cell-cell junction organization / response to vitamin D / positive regulation of vascular permeability / positive regulation of regulatory T cell differentiation /  transforming growth factor beta binding / response to cholesterol / deubiquitinase activator activity / digestive tract development / positive regulation of endothelial cell apoptotic process / negative regulation of interleukin-17 production / microglia development / surfactant homeostasis / negative regulation of release of sequestered calcium ion into cytosol / positive regulation of fibroblast migration / negative regulation of ossification / positive regulation of chemokine (C-X-C motif) ligand 2 production / aortic valve morphogenesis / phosphate-containing compound metabolic process / negative regulation of phagocytosis / negative regulation of protein localization to plasma membrane / transforming growth factor beta binding / response to cholesterol / deubiquitinase activator activity / digestive tract development / positive regulation of endothelial cell apoptotic process / negative regulation of interleukin-17 production / microglia development / surfactant homeostasis / negative regulation of release of sequestered calcium ion into cytosol / positive regulation of fibroblast migration / negative regulation of ossification / positive regulation of chemokine (C-X-C motif) ligand 2 production / aortic valve morphogenesis / phosphate-containing compound metabolic process / negative regulation of phagocytosis / negative regulation of protein localization to plasma membrane /  血管新生 / neural tube development / face morphogenesis / Molecules associated with elastic fibres / RUNX3 regulates CDKN1A transcription / ureteric bud development / ventricular cardiac muscle tissue morphogenesis / cellular response to insulin-like growth factor stimulus / positive regulation of epidermal growth factor receptor signaling pathway / negative regulation of neuroblast proliferation / macrophage derived foam cell differentiation / Syndecan interactions / muscle cell cellular homeostasis 血管新生 / neural tube development / face morphogenesis / Molecules associated with elastic fibres / RUNX3 regulates CDKN1A transcription / ureteric bud development / ventricular cardiac muscle tissue morphogenesis / cellular response to insulin-like growth factor stimulus / positive regulation of epidermal growth factor receptor signaling pathway / negative regulation of neuroblast proliferation / macrophage derived foam cell differentiation / Syndecan interactions / muscle cell cellular homeostasis類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.01 Å クライオ電子顕微鏡法 / 解像度: 4.01 Å | |||||||||
 データ登録者 データ登録者 | Duan Z / Zhang Z | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Specificity of TGF-β1 signal designated by LRRC33 and integrin αβ. 著者: Zelin Duan / Xuezhen Lin / Lixia Wang / Qiuxin Zhen / Yuefeng Jiang / Chuxin Chen / Jing Yang / Chia-Hsueh Lee / Yan Qin / Ying Li / Bo Zhao / Jianchuan Wang / Zhe Zhang /   要旨: Myeloid lineage cells present the latent form of transforming growth factor-β1 (L-TGF-β1) to the membrane using an anchor protein LRRC33. Integrin αβ activates extracellular L-TGF-β1 to trigger ...Myeloid lineage cells present the latent form of transforming growth factor-β1 (L-TGF-β1) to the membrane using an anchor protein LRRC33. Integrin αβ activates extracellular L-TGF-β1 to trigger the downstream signaling functions. However, the mechanism designating the specificity of TGF-β1 presentation and activation remains incompletely understood. Here, we report cryo-EM structures of human L-TGF-β1/LRRC33 and integrin αβ/L-TGF-β1 complexes. Combined with biochemical and cell-based analyses, we demonstrate that LRRC33 only presents L-TGF-β1 but not the -β2 or -β3 isoforms due to difference of key residues on the growth factor domains. Moreover, we reveal a 2:2 binding mode of integrin αβ and L-TGF-β1, which shows higher avidity and more efficient L-TGF-β1 activation than previously reported 1:2 binding mode. We also uncover that the disulfide-linked loop of the integrin subunit β determines its exquisite affinity to L-TGF-β1. Together, our findings provide important insights into the specificity of TGF-β1 signaling achieved by LRRC33 and integrin αβ. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33571.map.gz emd_33571.map.gz | 56.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33571-v30.xml emd-33571-v30.xml emd-33571.xml emd-33571.xml | 16.6 KB 16.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_33571.png emd_33571.png | 129.5 KB | ||
| その他 |  emd_33571_half_map_1.map.gz emd_33571_half_map_1.map.gz emd_33571_half_map_2.map.gz emd_33571_half_map_2.map.gz | 59.5 MB 59.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33571 http://ftp.pdbj.org/pub/emdb/structures/EMD-33571 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33571 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33571 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33571.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33571.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.055 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_33571_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
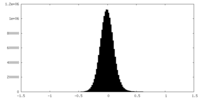
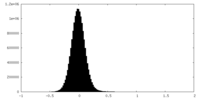
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_33571_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
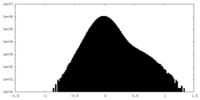
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : L-TGF-beta1 in complex with its anchor protein LRRC33
| 全体 | 名称: L-TGF-beta1 in complex with its anchor protein LRRC33 |
|---|---|
| 要素 |
|
-超分子 #1: L-TGF-beta1 in complex with its anchor protein LRRC33
| 超分子 | 名称: L-TGF-beta1 in complex with its anchor protein LRRC33 タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Homo sapiens (ヒト) / 組換細胞: HEK293 Homo sapiens (ヒト) / 組換細胞: HEK293 |
| 分子量 | 理論値: 150 KDa |
-分子 #1: Transforming growth factor beta-1 proprotein
| 分子 | 名称: Transforming growth factor beta-1 proprotein / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 43.010402 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MPLLLLLPLL WAGALALSTC KTIDMELVKR KRIEAIRGQI LSKLRLASPP SQGEVPPGPL PEAVLALYNS TRDRVAGESA EPEPEPEAD YYAKEVTRVL MVETHNEIYD KFKQSTHSIY MFFNTSELRE AVPEPVLLSR AELRLLRLKL KVEQHVELYQ K YSNNSWRY ...文字列: MPLLLLLPLL WAGALALSTC KTIDMELVKR KRIEAIRGQI LSKLRLASPP SQGEVPPGPL PEAVLALYNS TRDRVAGESA EPEPEPEAD YYAKEVTRVL MVETHNEIYD KFKQSTHSIY MFFNTSELRE AVPEPVLLSR AELRLLRLKL KVEQHVELYQ K YSNNSWRY LSNRLLAPSD SPEWLSFDVT GVVRQWLSRG GEIEGFRLSA HCSCDSRDNT LQVDINGFTT GRRGDLATIH GM NRPFLLL MATPLERAQH LQSSRHRRAL DTNYCFSSTE KNCCVRQLYI DFRKDLGWKW IHEPKGYHAN FCLGPCPYIW SLD TQYSKV LALYNQHNPG ASAAPCCVPQ ALEPLPIVYY VGRKPKVEQL SNMIVRSCKC S |
-分子 #2: Transforming growth factor beta activator LRRC33
| 分子 | 名称: Transforming growth factor beta activator LRRC33 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 72.191219 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MPLLLLLPLL WAGALAWRNR SGTATAASQG VCKLVGGAAD CRGQSLASVP SSLPPHARML TLDANPLKTL WNHSLQPYPL LESLSLHSC HLERISRGAF QEQGHLRSLV LGDNCLSENY EETAAALHAL PGLRRLDLSG NALTEDMAAL MLQNLSSLRS V SLAGNTIM ...文字列: MPLLLLLPLL WAGALAWRNR SGTATAASQG VCKLVGGAAD CRGQSLASVP SSLPPHARML TLDANPLKTL WNHSLQPYPL LESLSLHSC HLERISRGAF QEQGHLRSLV LGDNCLSENY EETAAALHAL PGLRRLDLSG NALTEDMAAL MLQNLSSLRS V SLAGNTIM RLDDSVFEGL ERLRELDLQR NYIFEIEGGA FDGLAELRHL NLAFNNLPCI VDFGLTRLRV LNVSYNVLEW FL ATGGEAA FELETLDLSH NQLLFFPLLP QYSKLRTLLL RDNNMGFYRD LYNTSSPREM VAQFLLVDGN VTNITTVSLW EEF SSSDLA DLRFLDMSQN QFQYLPDGFL RKMPSLSHLN LHQNCLMTLH IREHEPPGAL TELDLSHNQL SELHLAPGLA SCLG SLRLF NLSSNQLLGV PPGLFANARN ITTLDMSHNQ ISLCPLPAAS DRVGPPSCVD FRNMASLRSL SLEGCGLGAL PDCPF QGTS LTYLDLSSNW GVLNGSLAPL QDVAPMLQVL SLRNMGLHSS FMALDFSGFG NLRDLDLSGN CLTTFPRFGG SLALET LDL RRNSLTALPQ KAVSEQLSRG LRTIYLSQNP YDCCGVDGWG ALQHGQTVAD WAMVTCNLSS KIIRVTELPG GVPRDCK WE RLDLGSNSLE VLFQ |
-分子 #6: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 6 / コピー数: 1 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 1.2 µm / 最小 デフォーカス(公称値): 0.8 µm Bright-field microscopy / 最大 デフォーカス(公称値): 1.2 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 60.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期 角度割当 | タイプ: NOT APPLICABLE |
|---|---|
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.01 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 254673 |
-原子モデル構築 1
| 精密化 | プロトコル: OTHER |
|---|---|
| 得られたモデル |  PDB-7y1r: |
 ムービー
ムービー コントローラー
コントローラー























 Z
Z Y
Y X
X