+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | a22L prion fibril | |||||||||
 マップデータ マップデータ | Post processed, real space averaged map of anchorless 22L prion fibril | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process / glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / activation of protein kinase activity / cuprous ion binding / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / negative regulation of long-term synaptic potentiation / positive regulation of protein targeting to membrane / side of membrane / response to cadmium ion / regulation of peptidyl-tyrosine phosphorylation / glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / activation of protein kinase activity / cuprous ion binding / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / negative regulation of long-term synaptic potentiation / positive regulation of protein targeting to membrane / side of membrane / response to cadmium ion / regulation of peptidyl-tyrosine phosphorylation /  封入体 / cellular response to copper ion / neuron projection maintenance / protein sequestering activity / 封入体 / cellular response to copper ion / neuron projection maintenance / protein sequestering activity /  tubulin binding / negative regulation of protein phosphorylation / molecular condensate scaffold activity / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity / tubulin binding / negative regulation of protein phosphorylation / molecular condensate scaffold activity / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity /  terminal bouton / cellular response to amyloid-beta / terminal bouton / cellular response to amyloid-beta /  regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of neuron apoptotic process / cellular response to xenobiotic stimulus / regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of neuron apoptotic process / cellular response to xenobiotic stimulus /  signaling receptor activity / signaling receptor activity /  amyloid-beta binding / protein-folding chaperone binding / amyloid-beta binding / protein-folding chaperone binding /  microtubule binding / microtubule binding /  核膜 / 核膜 /  protease binding / response to oxidative stress / mitochondrial outer membrane / transmembrane transporter binding / protease binding / response to oxidative stress / mitochondrial outer membrane / transmembrane transporter binding /  postsynaptic density / molecular adaptor activity / learning or memory / postsynaptic density / molecular adaptor activity / learning or memory /  脂質ラフト / copper ion binding / intracellular membrane-bounded organelle / 脂質ラフト / copper ion binding / intracellular membrane-bounded organelle /  樹状突起 / protein-containing complex binding / negative regulation of apoptotic process / 樹状突起 / protein-containing complex binding / negative regulation of apoptotic process /  ゴルジ体 / ゴルジ体 /  細胞膜 / 細胞膜 /  小胞体 / 小胞体 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  metal ion binding / metal ion binding /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Mus musculus (ハツカネズミ) / Mus musculus (ハツカネズミ) /   house mouse (ハツカネズミ) house mouse (ハツカネズミ) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.2 Å クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Hoyt F / Caughey B | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: PLoS Pathog / 年: 2022 ジャーナル: PLoS Pathog / 年: 2022タイトル: Cryo-EM of prion strains from the same genotype of host identifies conformational determinants. 著者: Forrest Hoyt / Parvez Alam / Efrosini Artikis / Cindi L Schwartz / Andrew G Hughson / Brent Race / Chase Baune / Gregory J Raymond / Gerald S Baron / Allison Kraus / Byron Caughey /  要旨: Prion strains in a given type of mammalian host are distinguished by differences in clinical presentation, neuropathological lesions, survival time, and characteristics of the infecting prion protein ...Prion strains in a given type of mammalian host are distinguished by differences in clinical presentation, neuropathological lesions, survival time, and characteristics of the infecting prion protein (PrP) assemblies. Near-atomic structures of prions from two host species with different PrP sequences have been determined but comparisons of distinct prion strains of the same amino acid sequence are needed to identify purely conformational determinants of prion strain characteristics. Here we report a 3.2 Å resolution cryogenic electron microscopy-based structure of the 22L prion strain purified from the brains of mice engineered to express only PrP lacking glycophosphatidylinositol anchors [anchorless (a) 22L]. Comparison of this near-atomic structure to our recently determined structure of the aRML strain propagated in the same inbred mouse reveals that these two mouse prion strains have distinct conformational templates for growth via incorporation of PrP molecules of the same sequence. Both a22L and aRML are assembled as stacks of PrP molecules forming parallel in-register intermolecular β-sheets and intervening loops, with single monomers spanning the ordered fibril core. Each monomer shares an N-terminal steric zipper, three major arches, and an overall V-shape, but the details of these and other conformational features differ markedly. Thus, variations in shared conformational motifs within a parallel in-register β-stack fibril architecture provide a structural basis for prion strain differentiation within a single host genotype. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_28089.map.gz emd_28089.map.gz | 9.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-28089-v30.xml emd-28089-v30.xml emd-28089.xml emd-28089.xml | 16.5 KB 16.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_28089_fsc.xml emd_28089_fsc.xml | 13.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_28089.png emd_28089.png | 65.6 KB | ||
| その他 |  emd_28089_half_map_1.map.gz emd_28089_half_map_1.map.gz emd_28089_half_map_2.map.gz emd_28089_half_map_2.map.gz | 171.9 MB 171.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-28089 http://ftp.pdbj.org/pub/emdb/structures/EMD-28089 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28089 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28089 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8efuMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_28089.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_28089.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Post processed, real space averaged map of anchorless 22L prion fibril | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.045 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: EM half map for anchorless 22L prion fibril
| ファイル | emd_28089_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
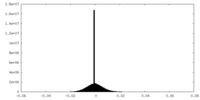
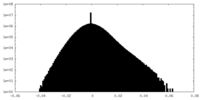
| 注釈 | EM half map for anchorless 22L prion fibril | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: EM half map for anchorless 22L prion fibril
| ファイル | emd_28089_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
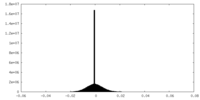
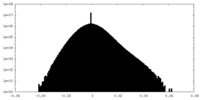
| 注釈 | EM half map for anchorless 22L prion fibril | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : GPI anchorless underglycosylated 22L prion fibril
| 全体 | 名称: GPI anchorless underglycosylated 22L prion fibril |
|---|---|
| 要素 |
|
-超分子 #1: GPI anchorless underglycosylated 22L prion fibril
| 超分子 | 名称: GPI anchorless underglycosylated 22L prion fibril / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) / 器官: Brain Mus musculus (ハツカネズミ) / 器官: Brain |
-分子 #1: Major prion protein
| 分子 | 名称: Major prion protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   house mouse (ハツカネズミ) house mouse (ハツカネズミ) |
| 分子量 | 理論値: 25.550348 KDa |
| 配列 | 文字列: MANLGYWLLA LFVTMWTDVG LCKKRPKPGG WNTGGSRYPG QGSPGGNRYP PQGGTWGQPH GGGWGQPHGG SWGQPHGGSW GQPHGGGWG QGGGTHNQWN KPSKPKTNLK HVAGAAAAGA VVGGLGGYML GSAMSRPMIH FGNDWEDRYY RENMYRYPNQ V YYRPVDQY ...文字列: MANLGYWLLA LFVTMWTDVG LCKKRPKPGG WNTGGSRYPG QGSPGGNRYP PQGGTWGQPH GGGWGQPHGG SWGQPHGGSW GQPHGGGWG QGGGTHNQWN KPSKPKTNLK HVAGAAAAGA VVGGLGGYML GSAMSRPMIH FGNDWEDRYY RENMYRYPNQ V YYRPVDQY SNQNNFVHDC VNITIKQHTV TTTTKGENFT ETDVKMMERV VEQMCVTQYQ KESQAYYDGR RSS |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 詳細: Sample suspended in 20 mM Tris pH 7.4, 100 mM containing 0.02% amphipol 8-35 |
|---|---|
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: OTHER |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 295 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 Bright-field microscopy / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 4449 / 平均電子線量: 57.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-8efu: |
 ムービー
ムービー コントローラー
コントローラー






 Z
Z Y
Y X
X