+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8csl | ||||||
|---|---|---|---|---|---|---|---|
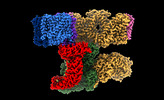
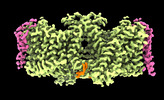
| タイトル | Sub-tomogram averaging of erythrocyte ankyrin-1 complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSPORT PROTEIN/STRUCTURAL PROTEIN /  Membrane protein (膜タンパク質) / Membrane protein (膜タンパク質) /  ankyrin complex (アンキリン) / TRANSPORT PROTEIN-STRUCTURAL PROTEIN complex ankyrin complex (アンキリン) / TRANSPORT PROTEIN-STRUCTURAL PROTEIN complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報methylammonium transmembrane transport / Defective RHAG causes regulator type Rh-null hemolytic anemia (RHN) / Rhesus blood group biosynthesis / methylammonium transmembrane transporter activity / Rhesus glycoproteins mediate ammonium transport. / carbon dioxide transmembrane transport / carbon dioxide transmembrane transporter activity / ammonium homeostasis / hemoglobin metabolic process / spectrin-associated cytoskeleton ...methylammonium transmembrane transport / Defective RHAG causes regulator type Rh-null hemolytic anemia (RHN) / Rhesus blood group biosynthesis / methylammonium transmembrane transporter activity / Rhesus glycoproteins mediate ammonium transport. / carbon dioxide transmembrane transport / carbon dioxide transmembrane transporter activity / ammonium homeostasis / hemoglobin metabolic process / spectrin-associated cytoskeleton / positive regulation of organelle organization /  protein-glutamine gamma-glutamyltransferase activity / maintenance of epithelial cell apical/basal polarity / ammonium transmembrane transport / protein-glutamine gamma-glutamyltransferase activity / maintenance of epithelial cell apical/basal polarity / ammonium transmembrane transport /  leak channel activity / pH elevation / Defective SLC4A1 causes hereditary spherocytosis type 4 (HSP4), distal renal tubular acidosis (dRTA) and dRTA with hemolytic anemia (dRTA-HA) / negative regulation of urine volume / NrCAM interactions / Bicarbonate transporters / Neurofascin interactions / intracellular monoatomic ion homeostasis / leak channel activity / pH elevation / Defective SLC4A1 causes hereditary spherocytosis type 4 (HSP4), distal renal tubular acidosis (dRTA) and dRTA with hemolytic anemia (dRTA-HA) / negative regulation of urine volume / NrCAM interactions / Bicarbonate transporters / Neurofascin interactions / intracellular monoatomic ion homeostasis /  ankyrin-1 complex / CHL1 interactions / plasma membrane phospholipid scrambling / monoatomic anion transmembrane transporter activity / ammonium channel activity / chloride:bicarbonate antiporter activity / cytoskeletal anchor activity / solute:inorganic anion antiporter activity / bicarbonate transport / bicarbonate transmembrane transporter activity / monoatomic anion transport / ankyrin-1 complex / CHL1 interactions / plasma membrane phospholipid scrambling / monoatomic anion transmembrane transporter activity / ammonium channel activity / chloride:bicarbonate antiporter activity / cytoskeletal anchor activity / solute:inorganic anion antiporter activity / bicarbonate transport / bicarbonate transmembrane transporter activity / monoatomic anion transport /  M band / inorganic cation transmembrane transport / Interaction between L1 and Ankyrins / chloride transport / chloride transmembrane transporter activity / M band / inorganic cation transmembrane transport / Interaction between L1 and Ankyrins / chloride transport / chloride transmembrane transporter activity /  ankyrin binding / negative regulation of glycolytic process through fructose-6-phosphate / ankyrin binding / negative regulation of glycolytic process through fructose-6-phosphate /  spectrin binding / spectrin binding /  hemoglobin binding / cortical cytoskeleton / hemoglobin binding / cortical cytoskeleton /  エキソサイトーシス / erythrocyte maturation / erythrocyte development / エキソサイトーシス / erythrocyte maturation / erythrocyte development /  axolemma / endoplasmic reticulum to Golgi vesicle-mediated transport / COPI-mediated anterograde transport / protein-membrane adaptor activity / spleen development / chloride transmembrane transport / cytoskeleton organization / axolemma / endoplasmic reticulum to Golgi vesicle-mediated transport / COPI-mediated anterograde transport / protein-membrane adaptor activity / spleen development / chloride transmembrane transport / cytoskeleton organization /  筋小胞体 / protein localization to plasma membrane / 筋小胞体 / protein localization to plasma membrane /  regulation of intracellular pH / Cell surface interactions at the vascular wall / carbon dioxide transport / cell morphogenesis / Erythrocytes take up oxygen and release carbon dioxide / Erythrocytes take up carbon dioxide and release oxygen / transmembrane transport / structural constituent of cytoskeleton / regulation of intracellular pH / Cell surface interactions at the vascular wall / carbon dioxide transport / cell morphogenesis / Erythrocytes take up oxygen and release carbon dioxide / Erythrocytes take up carbon dioxide and release oxygen / transmembrane transport / structural constituent of cytoskeleton /  筋鞘 / cytoplasmic side of plasma membrane / multicellular organismal-level iron ion homeostasis / Z disc / 筋鞘 / cytoplasmic side of plasma membrane / multicellular organismal-level iron ion homeostasis / Z disc /  凝固・線溶系 / virus receptor activity / regulation of cell shape / 凝固・線溶系 / virus receptor activity / regulation of cell shape /  ATPase binding / basolateral plasma membrane / ATPase binding / basolateral plasma membrane /  postsynaptic membrane / postsynaptic membrane /  protein phosphatase binding / transmembrane transporter binding / blood microparticle / protein phosphatase binding / transmembrane transporter binding / blood microparticle /  細胞骨格 / neuron projection / structural molecule activity / 細胞骨格 / neuron projection / structural molecule activity /  enzyme binding / enzyme binding /  シグナル伝達 / protein homodimerization activity / extracellular exosome / シグナル伝達 / protein homodimerization activity / extracellular exosome /  核質 / 核質 /  ATP binding / ATP binding /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  電子顕微鏡法 / サブトモグラム平均法 / 電子顕微鏡法 / サブトモグラム平均法 /  クライオ電子顕微鏡法 / 解像度: 25 Å クライオ電子顕微鏡法 / 解像度: 25 Å | ||||||
 データ登録者 データ登録者 | Vallese, F. / Kim, K. / Yen, L.Y. / Johnston, J.D. / Noble, A.J. / Cali, T. / Clarke, O.B. | ||||||
| 資金援助 | 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2022 ジャーナル: Nat Struct Mol Biol / 年: 2022タイトル: Architecture of the human erythrocyte ankyrin-1 complex. 著者: Francesca Vallese / Kookjoo Kim / Laura Y Yen / Jake D Johnston / Alex J Noble / Tito Calì / Oliver Biggs Clarke /   要旨: The stability and shape of the erythrocyte membrane is provided by the ankyrin-1 complex, but how it tethers the spectrin-actin cytoskeleton to the lipid bilayer and the nature of its association ...The stability and shape of the erythrocyte membrane is provided by the ankyrin-1 complex, but how it tethers the spectrin-actin cytoskeleton to the lipid bilayer and the nature of its association with the band 3 anion exchanger and the Rhesus glycoproteins remains unknown. Here we present structures of ankyrin-1 complexes purified from human erythrocytes. We reveal the architecture of a core complex of ankyrin-1, the Rhesus proteins RhAG and RhCE, the band 3 anion exchanger, protein 4.2, glycophorin A and glycophorin B. The distinct T-shaped conformation of membrane-bound ankyrin-1 facilitates recognition of RhCE and, unexpectedly, the water channel aquaporin-1. Together, our results uncover the molecular details of ankyrin-1 association with the erythrocyte membrane, and illustrate the mechanism of ankyrin-mediated membrane protein clustering. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8csl.cif.gz 8csl.cif.gz | 1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8csl.ent.gz pdb8csl.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8csl.json.gz 8csl.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cs/8csl https://data.pdbj.org/pub/pdb/validation_reports/cs/8csl ftp://data.pdbj.org/pub/pdb/validation_reports/cs/8csl ftp://data.pdbj.org/pub/pdb/validation_reports/cs/8csl | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  26965MC  7uz3C  7uzeC  7uzqC  7uzsC  7uzuC  7uzvC  7v07C  7v0kC  7v0mC  7v0qC  7v0sC  7v0tC  7v0uC  7v0xC  7v0yC  7v19C  8crqC  8crrC  8crtC  8cs9C  8csvC  8cswC  8csxC  8csyC  8ct2C  8ct3C  8cteC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 実験データセット #1 | データ参照:  10.6019/EMPIAR-11043 / データの種類: EMPIAR 10.6019/EMPIAR-11043 / データの種類: EMPIAR |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 7種, 19分子 AWVeYfZgKLQXPRaSbTc
| #1: タンパク質 |  / ANK-1 / Ankyrin-R / Erythrocyte ankyrin / ANK-1 / Ankyrin-R / Erythrocyte ankyrin分子量: 206522.625 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P16157 Homo sapiens (ヒト) / 参照: UniProt: P16157 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| #2: タンパク質 |  / Anion exchange protein 1 / AE 1 / Anion exchanger 1 / Solute carrier family 4 member 1 / Anion exchange protein 1 / AE 1 / Anion exchanger 1 / Solute carrier family 4 member 1分子量: 101883.859 Da / 分子数: 7 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P02730 Homo sapiens (ヒト) / 参照: UniProt: P02730#3: タンパク質 | | 分子量: 45598.918 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P18577 Homo sapiens (ヒト) / 参照: UniProt: P18577#4: タンパク質 | 分子量: 44229.629 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: Q02094 Homo sapiens (ヒト) / 参照: UniProt: Q02094#5: タンパク質 | |  / P4.2 / Erythrocyte membrane protein band 4.2 / Erythrocyte protein 4.2 / P4.2 / Erythrocyte membrane protein band 4.2 / Erythrocyte protein 4.2分子量: 77096.914 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P16452 Homo sapiens (ヒト) / 参照: UniProt: P16452#6: タンパク質 | | 分子量: 9789.674 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P06028 Homo sapiens (ヒト) / 参照: UniProt: P06028#7: タンパク質 | 分子量: 16348.433 Da / 分子数: 6 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P02724 Homo sapiens (ヒト) / 参照: UniProt: P02724 |
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: サブトモグラム平均法 |
- 試料調製
試料調製
| 構成要素 | 名称: Sub-tomogram average of ankyrin-1 complexes from native erythrocyte vesicles タイプ: COMPLEX / Entity ID: all / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.4 / 詳細: 130 mM KCl, 10 mM HEPES, pH 7.4 |
| 試料 | 濃度: 5 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES詳細: Ghost membranes (~100 mg) were pelleted (6,000 x g, 10 minutes), washed 5 times in 130 mM KCl, 10 mM HEPES, pH 7.4, and then homogenized with the same buffer. The sample was sonicated using ...詳細: Ghost membranes (~100 mg) were pelleted (6,000 x g, 10 minutes), washed 5 times in 130 mM KCl, 10 mM HEPES, pH 7.4, and then homogenized with the same buffer. The sample was sonicated using microprobe (amplitude = 30, pulse on = 5 sec, rest time = 10 sec, total pulse on = 50 sec). Large fragments are removed by centrifugation (6,000 x g, 10 minutes) and the supernatant was extruded (Avanti Polar Lipid) 10 times using a 400 nm filter. After extrusion, vesicles were collected by ultra-centrifugation at 35,000 rpm for 30 minutes (S120-AT3, Sorvall). The pellet, which contains vesicles, was resuspended at a final concentration of 5 mg/mL. All steps were performed at room temperature to facilitate vesicle formation. |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 5000 nm / 最小 デフォーカス(公称値): 3000 nm / Cs Bright-field microscopy / 最大 デフォーカス(公称値): 5000 nm / 最小 デフォーカス(公称値): 3000 nm / Cs : 0.01 mm : 0.01 mm |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 電子線照射量: 3.14 e/Å2 / Avg electron dose per subtomogram: 113 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
| 電子光学装置 | エネルギーフィルタースリット幅: 20 eV |
- 解析
解析
| EMソフトウェア |
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | 詳細: Warp / タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | |||||||||
3次元再構成 | 解像度: 25 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 1596 / 対称性のタイプ: POINT | |||||||||
| EM volume selection | 詳細: Picked using crYOLO, trained using manual picks. / Num. of tomograms: 100 / Num. of volumes extracted: 60029 | |||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT 詳細: Erythrocyte ankyrin-1 complex (Class1, 8CS9) was rigid fit as a single body to the map using fitmap in UCSF Chimera, after which waters, ligands and sidechains were removed from the model. | |||||||||
| 原子モデル構築 | PDB-ID: 8CS9 Accession code: 8CS9 / Source name: PDB / タイプ: experimental model |
 ムービー
ムービー コントローラー
コントローラー





























 PDBj
PDBj












