+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7u9z | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Structure of PKA phosphorylated human RyR2-R2474S in the open state | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  calcium channel (カルシウムチャネル) calcium channel (カルシウムチャネル) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報junctional sarcoplasmic reticulum membrane /  suramin binding / establishment of protein localization to endoplasmic reticulum / type B pancreatic cell apoptotic process / Purkinje myocyte to ventricular cardiac muscle cell signaling / regulation of SA node cell action potential / regulation of atrial cardiac muscle cell action potential / left ventricular cardiac muscle tissue morphogenesis / regulation of AV node cell action potential / positive regulation of ATPase-coupled calcium transmembrane transporter activity ...junctional sarcoplasmic reticulum membrane / suramin binding / establishment of protein localization to endoplasmic reticulum / type B pancreatic cell apoptotic process / Purkinje myocyte to ventricular cardiac muscle cell signaling / regulation of SA node cell action potential / regulation of atrial cardiac muscle cell action potential / left ventricular cardiac muscle tissue morphogenesis / regulation of AV node cell action potential / positive regulation of ATPase-coupled calcium transmembrane transporter activity ...junctional sarcoplasmic reticulum membrane /  suramin binding / establishment of protein localization to endoplasmic reticulum / type B pancreatic cell apoptotic process / Purkinje myocyte to ventricular cardiac muscle cell signaling / regulation of SA node cell action potential / regulation of atrial cardiac muscle cell action potential / left ventricular cardiac muscle tissue morphogenesis / regulation of AV node cell action potential / positive regulation of ATPase-coupled calcium transmembrane transporter activity / suramin binding / establishment of protein localization to endoplasmic reticulum / type B pancreatic cell apoptotic process / Purkinje myocyte to ventricular cardiac muscle cell signaling / regulation of SA node cell action potential / regulation of atrial cardiac muscle cell action potential / left ventricular cardiac muscle tissue morphogenesis / regulation of AV node cell action potential / positive regulation of ATPase-coupled calcium transmembrane transporter activity /  calcium-induced calcium release activity / sarcoplasmic reticulum calcium ion transport / ventricular cardiac muscle cell action potential / regulation of ventricular cardiac muscle cell action potential / positive regulation of sequestering of calcium ion / calcium-induced calcium release activity / sarcoplasmic reticulum calcium ion transport / ventricular cardiac muscle cell action potential / regulation of ventricular cardiac muscle cell action potential / positive regulation of sequestering of calcium ion /  cyclic nucleotide binding / embryonic heart tube morphogenesis / cardiac muscle hypertrophy / negative regulation of insulin secretion involved in cellular response to glucose stimulus / negative regulation of release of sequestered calcium ion into cytosol / ryanodine-sensitive calcium-release channel activity / neuronal action potential propagation / insulin secretion involved in cellular response to glucose stimulus / response to muscle activity / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / calcium ion transport into cytosol / regulation of cardiac muscle contraction by calcium ion signaling / response to caffeine / cell communication by electrical coupling involved in cardiac conduction / response to redox state / protein maturation by protein folding / 'de novo' protein folding / negative regulation of heart rate / negative regulation of phosphoprotein phosphatase activity / positive regulation of heart rate / cyclic nucleotide binding / embryonic heart tube morphogenesis / cardiac muscle hypertrophy / negative regulation of insulin secretion involved in cellular response to glucose stimulus / negative regulation of release of sequestered calcium ion into cytosol / ryanodine-sensitive calcium-release channel activity / neuronal action potential propagation / insulin secretion involved in cellular response to glucose stimulus / response to muscle activity / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / calcium ion transport into cytosol / regulation of cardiac muscle contraction by calcium ion signaling / response to caffeine / cell communication by electrical coupling involved in cardiac conduction / response to redox state / protein maturation by protein folding / 'de novo' protein folding / negative regulation of heart rate / negative regulation of phosphoprotein phosphatase activity / positive regulation of heart rate /  FK506 binding / positive regulation of axon regeneration / cellular response to caffeine / protein kinase A regulatory subunit binding / intracellularly gated calcium channel activity / protein kinase A catalytic subunit binding / positive regulation of the force of heart contraction / : / detection of calcium ion / smooth muscle contraction / FK506 binding / positive regulation of axon regeneration / cellular response to caffeine / protein kinase A regulatory subunit binding / intracellularly gated calcium channel activity / protein kinase A catalytic subunit binding / positive regulation of the force of heart contraction / : / detection of calcium ion / smooth muscle contraction /  小胞体 / negative regulation of ryanodine-sensitive calcium-release channel activity / response to vitamin E / regulation of cardiac muscle contraction / calcium channel inhibitor activity / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / protein peptidyl-prolyl isomerization / T cell proliferation / striated muscle contraction / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / release of sequestered calcium ion into cytosol / cardiac muscle contraction / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity / sarcoplasmic reticulum membrane / cellular response to epinephrine stimulus / 小胞体 / negative regulation of ryanodine-sensitive calcium-release channel activity / response to vitamin E / regulation of cardiac muscle contraction / calcium channel inhibitor activity / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / protein peptidyl-prolyl isomerization / T cell proliferation / striated muscle contraction / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / release of sequestered calcium ion into cytosol / cardiac muscle contraction / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity / sarcoplasmic reticulum membrane / cellular response to epinephrine stimulus /  calcium channel complex / regulation of cytosolic calcium ion concentration / response to muscle stretch / calcium channel complex / regulation of cytosolic calcium ion concentration / response to muscle stretch /  regulation of heart rate / regulation of heart rate /  筋小胞体 / 筋小胞体 /  プロリルイソメラーゼ / プロリルイソメラーゼ /  peptidyl-prolyl cis-trans isomerase activity / establishment of localization in cell / calcium-mediated signaling / peptidyl-prolyl cis-trans isomerase activity / establishment of localization in cell / calcium-mediated signaling /  calcium channel activity / response to hydrogen peroxide / Stimuli-sensing channels / calcium channel activity / response to hydrogen peroxide / Stimuli-sensing channels /  筋鞘 / Z disc / intracellular calcium ion homeostasis / calcium ion transport / : / positive regulation of cytosolic calcium ion concentration / protein refolding / transmembrane transporter binding / 筋鞘 / Z disc / intracellular calcium ion homeostasis / calcium ion transport / : / positive regulation of cytosolic calcium ion concentration / protein refolding / transmembrane transporter binding /  calmodulin binding / response to hypoxia / calmodulin binding / response to hypoxia /  signaling receptor binding / signaling receptor binding /  calcium ion binding / calcium ion binding /  enzyme binding / protein-containing complex / enzyme binding / protein-containing complex /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.29 Å クライオ電子顕微鏡法 / 解像度: 3.29 Å | ||||||
 データ登録者 データ登録者 | Miotto, M.C. / Marks, A.R. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2022 ジャーナル: Sci Adv / 年: 2022タイトル: Structural analyses of human ryanodine receptor type 2 channels reveal the mechanisms for sudden cardiac death and treatment. 著者: Marco C Miotto / Gunnar Weninger / Haikel Dridi / Qi Yuan / Yang Liu / Anetta Wronska / Zephan Melville / Leah Sittenfeld / Steven Reiken / Andrew R Marks /  要旨: Ryanodine receptor type 2 (RyR2) mutations have been linked to an inherited form of exercise-induced sudden cardiac death called catecholaminergic polymorphic ventricular tachycardia (CPVT). CPVT ...Ryanodine receptor type 2 (RyR2) mutations have been linked to an inherited form of exercise-induced sudden cardiac death called catecholaminergic polymorphic ventricular tachycardia (CPVT). CPVT results from stress-induced sarcoplasmic reticular Ca leak via the mutant RyR2 channels during diastole. We present atomic models of human wild-type (WT) RyR2 and the CPVT mutant RyR2-R2474S determined by cryo-electron microscopy with overall resolutions in the range of 2.6 to 3.6 Å, and reaching local resolutions of 2.25 Å, unprecedented for RyR2 channels. Under nonactivating conditions, the RyR2-R2474S channel is in a "primed" state between the closed and open states of WT RyR2, rendering it more sensitive to activation that results in stress-induced Ca leak. The Rycal drug ARM210 binds to RyR2-R2474S, reverting the primed state toward the closed state. Together, these studies provide a mechanism for CPVT and for the therapeutic actions of ARM210. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7u9z.cif.gz 7u9z.cif.gz | 2.9 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7u9z.ent.gz pdb7u9z.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  7u9z.json.gz 7u9z.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/u9/7u9z https://data.pdbj.org/pub/pdb/validation_reports/u9/7u9z ftp://data.pdbj.org/pub/pdb/validation_reports/u9/7u9z ftp://data.pdbj.org/pub/pdb/validation_reports/u9/7u9z | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  26410MC  7u9qC  7u9rC  7u9tC  7u9xC  7ua1C  7ua3C  7ua4C  7ua5C  7ua9C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 8分子 ABCDEFGH
| #1: タンパク質 |  / RYR-2 / RyR2 / hRYR-2 / Cardiac muscle ryanodine receptor / Cardiac muscle ryanodine receptor- ...RYR-2 / RyR2 / hRYR-2 / Cardiac muscle ryanodine receptor / Cardiac muscle ryanodine receptor-calcium release channel / Type 2 ryanodine receptor / RYR-2 / RyR2 / hRYR-2 / Cardiac muscle ryanodine receptor / Cardiac muscle ryanodine receptor- ...RYR-2 / RyR2 / hRYR-2 / Cardiac muscle ryanodine receptor / Cardiac muscle ryanodine receptor-calcium release channel / Type 2 ryanodine receptor分子量: 565216.000 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: RYR2 / 細胞株 (発現宿主): HEK293 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: RYR2 / 細胞株 (発現宿主): HEK293 / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: Q92736 Homo sapiens (ヒト) / 参照: UniProt: Q92736#2: タンパク質 | 分子量: 11798.501 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P68106, Escherichia coli (大腸菌) / 参照: UniProt: P68106,  プロリルイソメラーゼ プロリルイソメラーゼ |
|---|
-非ポリマー , 4種, 20分子 


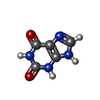



| #3: 化合物 | ChemComp-ZN / #4: 化合物 | ChemComp-ATP /  アデノシン三リン酸 アデノシン三リン酸#5: 化合物 | ChemComp-CA / #6: 化合物 | ChemComp-XAN /  キサンチン キサンチン |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 由来(組換発現) |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.4 詳細: Xanthine was made fresh to avoid aggregation. Xanthine stock solution was 10 mM in NaOH 0.5 N. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 2.2 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 1200 nm / 最小 デフォーカス(公称値): 400 nm Bright-field microscopy / 最大 デフォーカス(公称値): 1200 nm / 最小 デフォーカス(公称値): 400 nm |
| 撮影 | 電子線照射量: 58 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| EMソフトウェア | 名称: cryoSPARC / カテゴリ: CTF補正 |
|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION |
3次元再構成 | 解像度: 3.29 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 41126 / 対称性のタイプ: POINT |
| 原子モデル構築 | PDB-ID: 7U9X |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj









