+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7td6 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | aRML prion fibril | |||||||||
 要素 要素 | Major prion protein | |||||||||
 キーワード キーワード | PROTEIN FIBRIL / infectious prion /  amyloid (アミロイド) / parallel in-register amyloid (アミロイド) / parallel in-register | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process / glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / activation of protein kinase activity / cuprous ion binding / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / negative regulation of long-term synaptic potentiation / positive regulation of protein targeting to membrane / side of membrane / response to cadmium ion / regulation of peptidyl-tyrosine phosphorylation / glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / activation of protein kinase activity / cuprous ion binding / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / negative regulation of long-term synaptic potentiation / positive regulation of protein targeting to membrane / side of membrane / response to cadmium ion / regulation of peptidyl-tyrosine phosphorylation /  封入体 / cellular response to copper ion / neuron projection maintenance / protein sequestering activity / 封入体 / cellular response to copper ion / neuron projection maintenance / protein sequestering activity /  tubulin binding / negative regulation of protein phosphorylation / molecular condensate scaffold activity / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity / tubulin binding / negative regulation of protein phosphorylation / molecular condensate scaffold activity / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity /  terminal bouton / cellular response to amyloid-beta / terminal bouton / cellular response to amyloid-beta /  regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of neuron apoptotic process / cellular response to xenobiotic stimulus / regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of neuron apoptotic process / cellular response to xenobiotic stimulus /  signaling receptor activity / signaling receptor activity /  amyloid-beta binding / protein-folding chaperone binding / amyloid-beta binding / protein-folding chaperone binding /  microtubule binding / microtubule binding /  核膜 / 核膜 /  protease binding / response to oxidative stress / mitochondrial outer membrane / transmembrane transporter binding / protease binding / response to oxidative stress / mitochondrial outer membrane / transmembrane transporter binding /  postsynaptic density / molecular adaptor activity / learning or memory / postsynaptic density / molecular adaptor activity / learning or memory /  脂質ラフト / copper ion binding / intracellular membrane-bounded organelle / 脂質ラフト / copper ion binding / intracellular membrane-bounded organelle /  樹状突起 / protein-containing complex binding / negative regulation of apoptotic process / 樹状突起 / protein-containing complex binding / negative regulation of apoptotic process /  ゴルジ体 / ゴルジ体 /  細胞膜 / 細胞膜 /  小胞体 / 小胞体 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  metal ion binding / metal ion binding /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) | |||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3 Å クライオ電子顕微鏡法 / 解像度: 3 Å | |||||||||
 データ登録者 データ登録者 | Hoyt, F. / Standke, H.G. / Artikis, E. / Caughey, B. / Kraus, A. | |||||||||
| 資金援助 | 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Cryo-EM structure of anchorless RML prion reveals variations in shared motifs between distinct strains. 著者: Forrest Hoyt / Heidi G Standke / Efrosini Artikis / Cindi L Schwartz / Bryan Hansen / Kunpeng Li / Andrew G Hughson / Matteo Manca / Olivia R Thomas / Gregory J Raymond / Brent Race / Gerald ...著者: Forrest Hoyt / Heidi G Standke / Efrosini Artikis / Cindi L Schwartz / Bryan Hansen / Kunpeng Li / Andrew G Hughson / Matteo Manca / Olivia R Thomas / Gregory J Raymond / Brent Race / Gerald S Baron / Byron Caughey / Allison Kraus /  要旨: Little is known about the structural basis of prion strains. Here we provide a high (3.0 Å) resolution cryo-electron microscopy-based structure of infectious brain-derived fibrils of the mouse ...Little is known about the structural basis of prion strains. Here we provide a high (3.0 Å) resolution cryo-electron microscopy-based structure of infectious brain-derived fibrils of the mouse anchorless RML scrapie strain which, like the recently determined hamster 263K strain, has a parallel in-register β-sheet-based core. Several structural motifs are shared between these ex vivo prion strains, including an amino-proximal steric zipper and three β-arches. However, detailed comparisons reveal variations in these shared structural topologies and other features. Unlike 263K and wildtype RML prions, the anchorless RML prions lack glycophosphatidylinositol anchors and are severely deficient in N-linked glycans. Nonetheless, the similarity of our anchorless RML structure to one reported for wildtype RML prion fibrils in an accompanying paper indicates that these post-translational modifications do not substantially alter the amyloid core conformation. This work demonstrates both common and divergent structural features of prion strains at the near-atomic level. #1:  ジャーナル: Mol Cell / 年: 2021 ジャーナル: Mol Cell / 年: 2021タイトル: High-resolution structure and strain comparison of infectious mammalian prions. 著者: Allison Kraus / Forrest Hoyt / Cindi L Schwartz / Bryan Hansen / Efrosini Artikis / Andrew G Hughson / Gregory J Raymond / Brent Race / Gerald S Baron / Byron Caughey /  要旨: Within the extensive range of self-propagating pathologic protein aggregates of mammals, prions are the most clearly infectious (e.g., ∼10 lethal doses per milligram). The structures of such lethal ...Within the extensive range of self-propagating pathologic protein aggregates of mammals, prions are the most clearly infectious (e.g., ∼10 lethal doses per milligram). The structures of such lethal assemblies of PrP molecules have been poorly understood. Here we report a near-atomic core structure of a brain-derived, fully infectious prion (263K strain). Cryo-electron microscopy showed amyloid fibrils assembled with parallel in-register intermolecular β sheets. Each monomer provides one rung of the ordered fibril core, with N-linked glycans and glycolipid anchors projecting outward. Thus, single monomers form the templating surface for incoming monomers at fibril ends, where prion growth occurs. Comparison to another prion strain (aRML) revealed major differences in fibril morphology but, like 263K, an asymmetric fibril cross-section without paired protofilaments. These findings provide structural insights into prion propagation, strains, species barriers, and membrane pathogenesis. This structure also helps frame considerations of factors influencing the relative transmissibility of other pathologic amyloids. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7td6.cif.gz 7td6.cif.gz | 135.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7td6.ent.gz pdb7td6.ent.gz | 104.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7td6.json.gz 7td6.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/td/7td6 https://data.pdbj.org/pub/pdb/validation_reports/td/7td6 ftp://data.pdbj.org/pub/pdb/validation_reports/td/7td6 ftp://data.pdbj.org/pub/pdb/validation_reports/td/7td6 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  25824MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 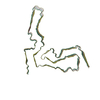
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域:
NCS oper:
|
- 要素
要素
| #1: タンパク質 | 分子量: 28008.393 Da / 分子数: 5 / 由来タイプ: 天然 詳細: proteinase-K resistant aRML prion fibril ordered core encompasses residues 93-230 由来: (天然)   Mus musculus (ハツカネズミ) / 参照: UniProt: P04925 Mus musculus (ハツカネズミ) / 参照: UniProt: P04925 |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: aRML prion / タイプ: COMPLEX / 詳細: anchorless RML prion fibril / Entity ID: all / 由来: NATURAL |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) / 組織: brain-derived Mus musculus (ハツカネズミ) / 組織: brain-derived |
| 緩衝液 | pH: 7.4 |
| 試料 | 濃度: 0.4 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES / 詳細: purified aRML prion fibrils : YES / 詳細: purified aRML prion fibrils |
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: C-flat-1.2/1.3 |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 81000 X / 最大 デフォーカス(公称値): 2700 nm / 最小 デフォーカス(公称値): 500 nm Bright-field microscopy / 倍率(公称値): 81000 X / 最大 デフォーカス(公称値): 2700 nm / 最小 デフォーカス(公称値): 500 nm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 60 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 135939 | ||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 15857 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 102.8 Å2 | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj

