+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7nyc | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
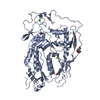
| タイトル | cryoEM structure of 3C9-sMAC | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード |  IMMUNE SYSTEM (免疫系) / Complement / IMMUNE SYSTEM (免疫系) / Complement /  MACPF / MACPF /  Membrane Attack Complex (膜侵襲複合体) / CDC / pore forming Membrane Attack Complex (膜侵襲複合体) / CDC / pore forming | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cell killing / Terminal pathway of complement /  膜侵襲複合体 / complement binding / other organism cell membrane / Activation of C3 and C5 / negative regulation of macrophage chemotaxis / 膜侵襲複合体 / complement binding / other organism cell membrane / Activation of C3 and C5 / negative regulation of macrophage chemotaxis /  complement activation, alternative pathway / complement activation, alternative pathway /  補体 / 補体 /  chemokine activity ...cell killing / Terminal pathway of complement / chemokine activity ...cell killing / Terminal pathway of complement /  膜侵襲複合体 / complement binding / other organism cell membrane / Activation of C3 and C5 / negative regulation of macrophage chemotaxis / 膜侵襲複合体 / complement binding / other organism cell membrane / Activation of C3 and C5 / negative regulation of macrophage chemotaxis /  complement activation, alternative pathway / complement activation, alternative pathway /  補体 / 補体 /  chemokine activity / chemokine activity /  retinol binding / retinol binding /  endopeptidase inhibitor activity / positive regulation of vascular endothelial growth factor production / positive regulation of chemokine production / Peptide ligand-binding receptors / endopeptidase inhibitor activity / positive regulation of vascular endothelial growth factor production / positive regulation of chemokine production / Peptide ligand-binding receptors /  complement activation, classical pathway / complement activation, classical pathway /  Regulation of Complement cascade / protein homooligomerization / Regulation of Complement cascade / protein homooligomerization /  走化性 / positive regulation of immune response / 走化性 / positive regulation of immune response /  extracellular vesicle / G alpha (i) signalling events / killing of cells of another organism / in utero embryonic development / blood microparticle / cell surface receptor signaling pathway / extracellular vesicle / G alpha (i) signalling events / killing of cells of another organism / in utero embryonic development / blood microparticle / cell surface receptor signaling pathway /  炎症 / 炎症 /  免疫応答 / G protein-coupled receptor signaling pathway / 免疫応答 / G protein-coupled receptor signaling pathway /  signaling receptor binding / signaling receptor binding /  自然免疫系 / protein-containing complex binding / 自然免疫系 / protein-containing complex binding /  extracellular space / extracellular exosome / extracellular region / extracellular space / extracellular exosome / extracellular region /  生体膜 / 生体膜 /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.54 Å クライオ電子顕微鏡法 / 解像度: 3.54 Å | ||||||||||||
 データ登録者 データ登録者 | Menny, A. / Couves, E.C. / Bubeck, D. | ||||||||||||
| 資金援助 | European Union,  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Structural basis of soluble membrane attack complex packaging for clearance. 著者: Anaïs Menny / Marie V Lukassen / Emma C Couves / Vojtech Franc / Albert J R Heck / Doryen Bubeck /   要旨: Unregulated complement activation causes inflammatory and immunological pathologies with consequences for human disease. To prevent bystander damage during an immune response, extracellular ...Unregulated complement activation causes inflammatory and immunological pathologies with consequences for human disease. To prevent bystander damage during an immune response, extracellular chaperones (clusterin and vitronectin) capture and clear soluble precursors to the membrane attack complex (sMAC). However, how these chaperones block further polymerization of MAC and prevent the complex from binding target membranes remains unclear. Here, we address that question by combining cryo electron microscopy (cryoEM) and cross-linking mass spectrometry (XL-MS) to solve the structure of sMAC. Together our data reveal how clusterin recognizes and inhibits polymerizing complement proteins by binding a negatively charged surface of sMAC. Furthermore, we show that the pore-forming C9 protein is trapped in an intermediate conformation whereby only one of its two transmembrane β-hairpins has unfurled. This structure provides molecular details for immune pore formation and helps explain a complement control mechanism that has potential implications for how cell clearance pathways mediate immune homeostasis. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7nyc.cif.gz 7nyc.cif.gz | 1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7nyc.ent.gz pdb7nyc.ent.gz | 843.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7nyc.json.gz 7nyc.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ny/7nyc https://data.pdbj.org/pub/pdb/validation_reports/ny/7nyc ftp://data.pdbj.org/pub/pdb/validation_reports/ny/7nyc ftp://data.pdbj.org/pub/pdb/validation_reports/ny/7nyc | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Complement component ... , 6種, 8分子 CDEGHIBF
| #1: タンパク質 | 分子量: 91221.484 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P10643 Homo sapiens (ヒト) / 参照: UniProt: P10643 | ||||
|---|---|---|---|---|---|
| #2: タンパク質 | 分子量: 61122.852 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P07358 Homo sapiens (ヒト) / 参照: UniProt: P07358 | ||||
| #3: タンパク質 | 分子量: 61782.992 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P07357 Homo sapiens (ヒト) / 参照: UniProt: P07357 | ||||
| #4: タンパク質 | 分子量: 61056.594 Da / 分子数: 3 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P02748 Homo sapiens (ヒト) / 参照: UniProt: P02748#5: タンパク質 | | 分子量: 102541.312 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P13671 Homo sapiens (ヒト) / 参照: UniProt: P13671#7: タンパク質 | | 分子量: 20410.105 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P07360 Homo sapiens (ヒト) / 参照: UniProt: P07360 |
-タンパク質 / 非ポリマー , 2種, 4分子 A

| #11: 化合物 | | #6: タンパク質 | |  Complement component 5 / C3 and PZP-like alpha-2-macroglobulin domain-containing protein 4 Complement component 5 / C3 and PZP-like alpha-2-macroglobulin domain-containing protein 4分子量: 186546.656 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / 参照: UniProt: P01031 Homo sapiens (ヒト) / 参照: UniProt: P01031 |
|---|
-糖 , 5種, 14分子 



| #8: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose オリゴ糖 / 分子量: 424.401 Da / 分子数: 1 / 由来タイプ: 組換発現 オリゴ糖 / 分子量: 424.401 Da / 分子数: 1 / 由来タイプ: 組換発現 | ||||
|---|---|---|---|---|---|
| #9: 多糖 | beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta- ...beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose オリゴ糖 / 分子量: 586.542 Da / 分子数: 1 / 由来タイプ: 組換発現 オリゴ糖 / 分子量: 586.542 Da / 分子数: 1 / 由来タイプ: 組換発現 | ||||
| #10: 糖 | ChemComp-BMA /  マンノース マンノース#12: 糖 | ChemComp-NAG /  N-アセチルグルコサミン N-アセチルグルコサミン#13: 糖 | ChemComp-FUC / |  フコース フコース |
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: 3C9-sMAC / タイプ: COMPLEX 詳細: This sMAC oligomer contains one copy of C5b8 and 3 copies of C9, as well as multiple copies of the chaperones vitronectin and clusterin Entity ID: #1-#7 / 由来: NATURAL |
|---|---|
| 分子量 | 値: 1 MDa / 実験値: YES |
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.4 |
| 試料 | 濃度: 0.065 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 装置: FEI VITROBOT MARK III / 凍結剤: ETHANE / 湿度: 95 % / 凍結前の試料温度: 295 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / C2レンズ絞り径: 70 µm Bright-field microscopy / C2レンズ絞り径: 70 µm |
| 撮影 | 電子線照射量: 40 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: REFMAC / バージョン: 5.8.0253 / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.54 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 85151 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 解像度: 3.5→418.8 Å / Cor.coef. Fo:Fc: 0.891 / SU B: 16.753 / SU ML: 0.236 / ESU R: 0.166 立体化学のターゲット値: MAXIMUM LIKELIHOOD WITH PHASES
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: PARAMETERS FOR MASK CACLULATION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 268.658 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: 1 / 合計: 41391 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj