+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the PP2A:B55-FAM122A complex | ||||||||||||
 マップデータ マップデータ | Relion 3D auto-refine merged map | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Protein Phosphatase 2A:B55 holoenzyme FAM122A inhibitor substrate binding cell cycle regulation /  SIGNALING PROTEIN SIGNALING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報meiotic spindle elongation / Integration of energy metabolism / PP2A-mediated dephosphorylation of key metabolic factors / protein serine/threonine phosphatase inhibitor activity /  regulation of microtubule binding / MASTL Facilitates Mitotic Progression / mitotic sister chromatid separation / regulation of meiotic cell cycle process involved in oocyte maturation / protein phosphatase type 2A complex / meiotic sister chromatid cohesion, centromeric ...meiotic spindle elongation / Integration of energy metabolism / PP2A-mediated dephosphorylation of key metabolic factors / protein serine/threonine phosphatase inhibitor activity / regulation of microtubule binding / MASTL Facilitates Mitotic Progression / mitotic sister chromatid separation / regulation of meiotic cell cycle process involved in oocyte maturation / protein phosphatase type 2A complex / meiotic sister chromatid cohesion, centromeric ...meiotic spindle elongation / Integration of energy metabolism / PP2A-mediated dephosphorylation of key metabolic factors / protein serine/threonine phosphatase inhibitor activity /  regulation of microtubule binding / MASTL Facilitates Mitotic Progression / mitotic sister chromatid separation / regulation of meiotic cell cycle process involved in oocyte maturation / protein phosphatase type 2A complex / meiotic sister chromatid cohesion, centromeric / peptidyl-serine dephosphorylation / peptidyl-threonine dephosphorylation / positive regulation of microtubule binding / Regulation of glycolysis by fructose 2,6-bisphosphate metabolism / Inhibition of replication initiation of damaged DNA by RB1/E2F1 / female meiotic nuclear division / protein antigen binding / protein phosphatase regulator activity / regulation of microtubule binding / MASTL Facilitates Mitotic Progression / mitotic sister chromatid separation / regulation of meiotic cell cycle process involved in oocyte maturation / protein phosphatase type 2A complex / meiotic sister chromatid cohesion, centromeric / peptidyl-serine dephosphorylation / peptidyl-threonine dephosphorylation / positive regulation of microtubule binding / Regulation of glycolysis by fructose 2,6-bisphosphate metabolism / Inhibition of replication initiation of damaged DNA by RB1/E2F1 / female meiotic nuclear division / protein antigen binding / protein phosphatase regulator activity /  GABA receptor binding / APC truncation mutants have impaired AXIN binding / AXIN missense mutants destabilize the destruction complex / Truncations of AMER1 destabilize the destruction complex / Initiation of Nuclear Envelope (NE) Reformation / ERKs are inactivated / negative regulation of epithelial to mesenchymal transition / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / Beta-catenin phosphorylation cascade / Signaling by GSK3beta mutants / CTNNB1 S33 mutants aren't phosphorylated / CTNNB1 S37 mutants aren't phosphorylated / CTNNB1 S45 mutants aren't phosphorylated / CTNNB1 T41 mutants aren't phosphorylated / mitotic G2/M transition checkpoint / response to morphine / regulation of growth / Disassembly of the destruction complex and recruitment of AXIN to the membrane / negative regulation of glycolytic process through fructose-6-phosphate / positive regulation of NLRP3 inflammasome complex assembly / myosin phosphatase activity / CTLA4 inhibitory signaling / GABA receptor binding / APC truncation mutants have impaired AXIN binding / AXIN missense mutants destabilize the destruction complex / Truncations of AMER1 destabilize the destruction complex / Initiation of Nuclear Envelope (NE) Reformation / ERKs are inactivated / negative regulation of epithelial to mesenchymal transition / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / Beta-catenin phosphorylation cascade / Signaling by GSK3beta mutants / CTNNB1 S33 mutants aren't phosphorylated / CTNNB1 S37 mutants aren't phosphorylated / CTNNB1 S45 mutants aren't phosphorylated / CTNNB1 T41 mutants aren't phosphorylated / mitotic G2/M transition checkpoint / response to morphine / regulation of growth / Disassembly of the destruction complex and recruitment of AXIN to the membrane / negative regulation of glycolytic process through fructose-6-phosphate / positive regulation of NLRP3 inflammasome complex assembly / myosin phosphatase activity / CTLA4 inhibitory signaling /  protein serine/threonine phosphatase activity / Platelet sensitization by LDL / protein-serine/threonine phosphatase / protein serine/threonine phosphatase activity / Platelet sensitization by LDL / protein-serine/threonine phosphatase /  regulation of cell differentiation / ERK/MAPK targets / T cell homeostasis / regulation of G1/S transition of mitotic cell cycle / regulation of cell differentiation / ERK/MAPK targets / T cell homeostasis / regulation of G1/S transition of mitotic cell cycle /  phosphoprotein phosphatase activity / mesoderm development / phosphoprotein phosphatase activity / mesoderm development /  chromosome, centromeric region / DARPP-32 events / lateral plasma membrane / negative regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / Cyclin A/B1/B2 associated events during G2/M transition / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / protein dephosphorylation / meiotic cell cycle / chromosome, centromeric region / DARPP-32 events / lateral plasma membrane / negative regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / Cyclin A/B1/B2 associated events during G2/M transition / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / protein dephosphorylation / meiotic cell cycle /  protein tyrosine phosphatase activity / protein tyrosine phosphatase activity /  chromosome segregation / RHO GTPases Activate Formins / response to lead ion / chromosome segregation / RHO GTPases Activate Formins / response to lead ion /  regulation of protein phosphorylation / Spry regulation of FGF signaling / RAF activation / PKR-mediated signaling / Degradation of beta-catenin by the destruction complex / tau protein binding / positive regulation of protein serine/threonine kinase activity / regulation of protein phosphorylation / Spry regulation of FGF signaling / RAF activation / PKR-mediated signaling / Degradation of beta-catenin by the destruction complex / tau protein binding / positive regulation of protein serine/threonine kinase activity /  紡錘体 / Negative regulation of MAPK pathway / Separation of Sister Chromatids / Cyclin D associated events in G1 / microtubule cytoskeleton / 紡錘体 / Negative regulation of MAPK pathway / Separation of Sister Chromatids / Cyclin D associated events in G1 / microtubule cytoskeleton /  Regulation of PLK1 Activity at G2/M Transition / Regulation of TP53 Degradation / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / mitotic cell cycle / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / positive regulation of cell growth / protein-containing complex assembly / Regulation of PLK1 Activity at G2/M Transition / Regulation of TP53 Degradation / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / mitotic cell cycle / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / positive regulation of cell growth / protein-containing complex assembly /  nuclear body / intracellular signal transduction / neuron projection / nuclear body / intracellular signal transduction / neuron projection /  脂質ラフト / protein heterodimerization activity / neuronal cell body / glutamatergic synapse / 脂質ラフト / protein heterodimerization activity / neuronal cell body / glutamatergic synapse /  シナプス / シナプス /  樹状突起 / 樹状突起 /  ミトコンドリア ミトコンドリア類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
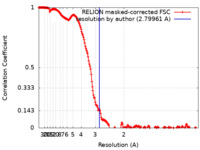
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.79961 Å クライオ電子顕微鏡法 / 解像度: 2.79961 Å | ||||||||||||
 データ登録者 データ登録者 | Fuller JR / Padi SKR / Peti W / Page R | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 | ジャーナル: Acta Crystallogr D Struct Biol / 年: 2018 タイトル: Real-space refinement in PHENIX for cryo-EM and crystallography. 著者: Pavel V Afonine / Billy K Poon / Randy J Read / Oleg V Sobolev / Thomas C Terwilliger / Alexandre Urzhumtsev / Paul D Adams /    要旨: This article describes the implementation of real-space refinement in the phenix.real_space_refine program from the PHENIX suite. The use of a simplified refinement target function enables very fast ...This article describes the implementation of real-space refinement in the phenix.real_space_refine program from the PHENIX suite. The use of a simplified refinement target function enables very fast calculation, which in turn makes it possible to identify optimal data-restraint weights as part of routine refinements with little runtime cost. Refinement of atomic models against low-resolution data benefits from the inclusion of as much additional information as is available. In addition to standard restraints on covalent geometry, phenix.real_space_refine makes use of extra information such as secondary-structure and rotamer-specific restraints, as well as restraints or constraints on internal molecular symmetry. The re-refinement of 385 cryo-EM-derived models available in the Protein Data Bank at resolutions of 6 Å or better shows significant improvement of the models and of the fit of these models to the target maps. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40644.map.gz emd_40644.map.gz | 486.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40644-v30.xml emd-40644-v30.xml emd-40644.xml emd-40644.xml | 33 KB 33 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_40644_fsc.xml emd_40644_fsc.xml | 19.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_40644.png emd_40644.png | 110.4 KB | ||
| マスクデータ |  emd_40644_msk_1.map emd_40644_msk_1.map | 600.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-40644.cif.gz emd-40644.cif.gz | 8.3 KB | ||
| その他 |  emd_40644_additional_1.map.gz emd_40644_additional_1.map.gz emd_40644_additional_2.map.gz emd_40644_additional_2.map.gz emd_40644_additional_3.map.gz emd_40644_additional_3.map.gz emd_40644_half_map_1.map.gz emd_40644_half_map_1.map.gz emd_40644_half_map_2.map.gz emd_40644_half_map_2.map.gz | 558.1 MB 362.9 MB 570 MB 487.5 MB 487.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40644 http://ftp.pdbj.org/pub/emdb/structures/EMD-40644 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40644 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40644 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40644.map.gz / 形式: CCP4 / 大きさ: 600.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40644.map.gz / 形式: CCP4 / 大きさ: 600.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Relion 3D auto-refine merged map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.534 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_40644_msk_1.map emd_40644_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
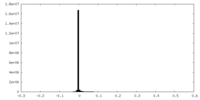
| 投影像・断面図 |
| ||||||||||||
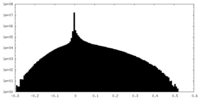
| 密度ヒストグラム |
-追加マップ: Relion post-processed map, sharpened by automatically determined B-factor...
| ファイル | emd_40644_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Relion post-processed map, sharpened by automatically determined B-factor (-32.3355) | ||||||||||||
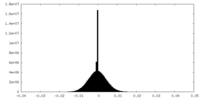
| 投影像・断面図 |
| ||||||||||||
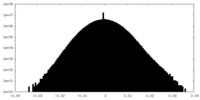
| 密度ヒストグラム |
-追加マップ: Sharpened, local resolution-filtered map, as determined by the...
| ファイル | emd_40644_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened, local resolution-filtered map, as determined by the algorithm implemented in Relion | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: LAFTER filtered map (using --sharp option)
| ファイル | emd_40644_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | LAFTER filtered map (using --sharp option) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Relion 3D auto-refine half map 1
| ファイル | emd_40644_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Relion 3D auto-refine half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Relion 3D auto-refine half map 2
| ファイル | emd_40644_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Relion 3D auto-refine half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Quadruple complex of PP2A:B55 (PP2Aa:PP2Ac:B55) bound to FAM122A
| 全体 | 名称: Quadruple complex of PP2A:B55 (PP2Aa:PP2Ac:B55) bound to FAM122A |
|---|---|
| 要素 |
|
-超分子 #1: Quadruple complex of PP2A:B55 (PP2Aa:PP2Ac:B55) bound to FAM122A
| 超分子 | 名称: Quadruple complex of PP2A:B55 (PP2Aa:PP2Ac:B55) bound to FAM122A タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|
-分子 #1: Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit...
| 分子 | 名称: Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 64.95798 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: GHMSLYPIAV LIDELRNEDV QLRLNSIKKL STIALALGVE RTRSELLPFL TDTIYDEDEV LLALAEQLGT FTTLVGGPEY VHCLLPPLE SLATVEETVV RDKAVESLRA ISHEHSPSDL EAHFVPLVKR LAGGDWFTSR TSACGLFSVC YPRVSSAVKA E LRQYFRNL ...文字列: GHMSLYPIAV LIDELRNEDV QLRLNSIKKL STIALALGVE RTRSELLPFL TDTIYDEDEV LLALAEQLGT FTTLVGGPEY VHCLLPPLE SLATVEETVV RDKAVESLRA ISHEHSPSDL EAHFVPLVKR LAGGDWFTSR TSACGLFSVC YPRVSSAVKA E LRQYFRNL CSDDTPMVRR AAASKLGEFA KVLELDNVKS EIIPMFSNLA SDEQDSVRLL AVEACVNIAQ LLPQEDLEAL VM PTLRQAA EDKSWRVRYM VADKFTELQK AVGPEITKTD LVPAFQNLMK DCEAEVRAAA SHKVKEFCEN LSADCRENVI MSQ ILPCIK ELVSDANQHV KSALASVIMG LSPILGKDNT IEHLLPLFLA QLKDECPEVR LNIISNLDCV NEVIGIRQLS QSLL PAIVE LAEDAKWRVR LAIIEYMPLL AGQLGVEFFD EKLNSLCMAW LVDHVYAIRE AATSNLKKLV EKFGKEWAHA TIIPK VLAM SGDPNYLHRM TTLFCINVLS EVCGQDITTK HMLPTVLRMA GDPVANVRFN VAKSLQKIGP ILDNSTLQSE VKPILE KLT QDQDVDVKYF AQEALTVLSL A UniProtKB: Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform |
-分子 #2: Serine/threonine-protein phosphatase 2A 55 kDa regulatory subunit...
| 分子 | 名称: Serine/threonine-protein phosphatase 2A 55 kDa regulatory subunit B alpha isoform タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 52.10134 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GHMGSAGAGG GNDIQWCFSQ VKGAVDDDVA EADIISTVEF NHSGELLATG DKGGRVVIFQ QEQENKIQSH SRGEYNVYST FQSHEPEFD YLKSLEIEEK INKIRWLPQK NAAQFLLSTN DKTIKLWKIS ERDKRPEGYN LKEEDGRYRD PTTVTTLRVP V FRPMDLMV ...文字列: GHMGSAGAGG GNDIQWCFSQ VKGAVDDDVA EADIISTVEF NHSGELLATG DKGGRVVIFQ QEQENKIQSH SRGEYNVYST FQSHEPEFD YLKSLEIEEK INKIRWLPQK NAAQFLLSTN DKTIKLWKIS ERDKRPEGYN LKEEDGRYRD PTTVTTLRVP V FRPMDLMV EASPRRIFAN AHTYHINSIS INSDYETYLS ADDLRINLWH LEITDRSFNI VDIKPANMEE LTEVITAAEF HP NSCNTFV YSSSKGTIRL CDMRASALCD RHSKLFEEPE DPSNRSFFSE IISSISDVKF SHSGRYMMTR DYLSVKIWDL NME NRPVET YQVHEYLRSK LCSLYENDCI FDKFECCWNG SDSVVMTGSY NNFFRMFDRN TKRDITLEAS RENNKPRTVL KPRK VCASG KRKKDEISVD SLDFNKKILH TAWHPKENII AVATTNNLYI FQDKVN UniProtKB: Serine/threonine-protein phosphatase 2A 55 kDa regulatory subunit B alpha isoform |
-分子 #3: Serine/threonine-protein phosphatase 2A catalytic subunit alpha i...
| 分子 | 名称: Serine/threonine-protein phosphatase 2A catalytic subunit alpha isoform タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO / EC番号: protein-serine/threonine phosphatase |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 35.845375 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GHMDEKVFTK ELDQWIEQLN ECKQLSESQV KSLCEKAKEI LTKESNVQEV RCPVTVCGDV HGQFHDLMEL FRIGGKSPDT NYLFMGDYV DRGYYSVETV TLLVALKVRY RERITILRGN HESRQITQVY GFYDECLRKY GNANVWKYFT DLFDYLPLTA L VDGQIFCL ...文字列: GHMDEKVFTK ELDQWIEQLN ECKQLSESQV KSLCEKAKEI LTKESNVQEV RCPVTVCGDV HGQFHDLMEL FRIGGKSPDT NYLFMGDYV DRGYYSVETV TLLVALKVRY RERITILRGN HESRQITQVY GFYDECLRKY GNANVWKYFT DLFDYLPLTA L VDGQIFCL HGGLSPSIDT LDHIRALDRL QEVPHEGPMC DLLWSDPDDR GGWGISPRGA GYTFGQDISE TFNHANGLTL VS RAHQLVM EGYNWCHDRN VVTIFSAPNY CYRCGNQAAI MELDDTLKYS FLQFDPAPRR GEPHVTRRTP DYF(MLL) UniProtKB: Serine/threonine-protein phosphatase 2A catalytic subunit alpha isoform |
-分子 #4: PPP2R1A-PPP2R2A-interacting phosphatase regulator 1
| 分子 | 名称: PPP2R1A-PPP2R2A-interacting phosphatase regulator 1 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 10.680907 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: GHMGGGLRRS NSAPLIHGLS DSSPVFQDEA PSARRNRTTF PSRHGLLLPA SPVRMHSSRL HQIKQEEGMD LINRETVHER EVQTAMQIS HSWEES UniProtKB: PPP2R1A-PPP2R2A-interacting phosphatase regulator 1 |
-分子 #5: FE (III) ION
| 分子 | 名称: FE (III) ION / タイプ: ligand / ID: 5 / コピー数: 1 / 式: FE |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #6: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 6 / コピー数: 1 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.2 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: CHAPSO was added only immediately prior to vitrification | ||||||||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 35 sec. / 前処理 - 雰囲気: AIR / 詳細: Gatan Solarus, 20W power for 35s using room air | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 291 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm 最大 デフォーカス(補正後): 2.5300000000000002 µm 最小 デフォーカス(補正後): 0.55 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD  Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm最大 デフォーカス(公称値): 1.9000000000000001 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 81000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 平均電子線量: 70.0 e/Å2 詳細: Camera was operated in CDS mode, writing super-resolution movies with 59 frames |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||
|---|---|---|---|---|---|---|---|
| 詳細 | Iterating between manual refinement in Coot and automated real-space refinement in Phenix | ||||||
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 当てはまり具合の基準: Cross-correlation | ||||||
| 得られたモデル |  PDB-8so0: |
 ムービー
ムービー コントローラー
コントローラー




























 Z
Z Y
Y X
X