+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22182 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | YSD1 bacteriophage capsid | ||||||||||||
 マップデータ マップデータ | Sharpened masked map | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Bacteriophage capsid /  VIRUS (ウイルス) VIRUS (ウイルス) | ||||||||||||
| 機能・相同性 | Head decoration protein D / Bacteriophage lambda head decoration protein D / Major capsid protein GpE / Phage major capsid protein E /  カプシド / host cell cytoplasm / Putative+head+decorative+protein / Major capsid protein カプシド / host cell cytoplasm / Putative+head+decorative+protein / Major capsid protein 機能・相同性情報 機能・相同性情報 | ||||||||||||
| 生物種 |   Bacteriophage sp. (ファージ) Bacteriophage sp. (ファージ) | ||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.8 Å クライオ電子顕微鏡法 / 解像度: 3.8 Å | ||||||||||||
 データ登録者 データ登録者 | Hardy JM / Dunstan R | ||||||||||||
| 資金援助 |  オーストラリア, オーストラリア,  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: The architecture and stabilisation of flagellotropic tailed bacteriophages. 著者: Joshua M Hardy / Rhys A Dunstan / Rhys Grinter / Matthew J Belousoff / Jiawei Wang / Derek Pickard / Hariprasad Venugopal / Gordon Dougan / Trevor Lithgow / Fasséli Coulibaly /   要旨: Flagellotropic bacteriophages engage flagella to reach the bacterial surface as an effective means to increase the capture radius for predation. Structural details of these viruses are of great ...Flagellotropic bacteriophages engage flagella to reach the bacterial surface as an effective means to increase the capture radius for predation. Structural details of these viruses are of great interest given the substantial drag forces and torques they face when moving down the spinning flagellum. We show that the main capsid and auxiliary proteins form two nested chainmails that ensure the integrity of the bacteriophage head. Core stabilising structures are conserved in herpesviruses suggesting their ancestral origin. The structure of the tail also reveals a robust yet pliable assembly. Hexameric rings of the tail-tube protein are braced by the N-terminus and a β-hairpin loop, and interconnected along the tail by the splayed β-hairpins. By contrast, we show that the β-hairpin has an inhibitory role in the tail-tube precursor, preventing uncontrolled self-assembly. Dyads of acidic residues inside the tail-tube present regularly-spaced motifs well suited to DNA translocation into bacteria through the tail. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22182.map.gz emd_22182.map.gz | 195.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22182-v30.xml emd-22182-v30.xml emd-22182.xml emd-22182.xml | 22.3 KB 22.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_22182_fsc.xml emd_22182_fsc.xml | 28.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_22182.png emd_22182.png | 262 KB | ||
| マスクデータ |  emd_22182_msk_1.map emd_22182_msk_1.map | 824 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-22182.cif.gz emd-22182.cif.gz | 6.4 KB | ||
| その他 |  emd_22182_additional.map.gz emd_22182_additional.map.gz emd_22182_half_map_1.map.gz emd_22182_half_map_1.map.gz emd_22182_half_map_2.map.gz emd_22182_half_map_2.map.gz | 763.7 MB 748.3 MB 749.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22182 http://ftp.pdbj.org/pub/emdb/structures/EMD-22182 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22182 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22182 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22182.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22182.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened masked map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.34 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_22182_msk_1.map emd_22182_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
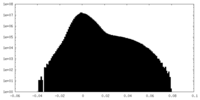
| 密度ヒストグラム |
-追加マップ: Sharpened map
| ファイル | emd_22182_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
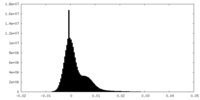
| 密度ヒストグラム |
-ハーフマップ: Half map 1
| ファイル | emd_22182_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
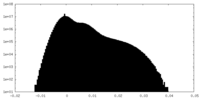
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_22182_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Bacteriophage sp.
| 全体 | 名称:   Bacteriophage sp. (ファージ) Bacteriophage sp. (ファージ) |
|---|---|
| 要素 |
|
-超分子 #1: Bacteriophage sp.
| 超分子 | 名称: Bacteriophage sp. / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: From environmental water samples taken during a phage survey of the waterways of Cambridge UK, the phage YSD1 was isolated using the attenuated S. enterica serovar Typhi BRD948. The virus was ...詳細: From environmental water samples taken during a phage survey of the waterways of Cambridge UK, the phage YSD1 was isolated using the attenuated S. enterica serovar Typhi BRD948. The virus was then amplified by infecting S. Typhimurium SL3261 delta-fljB. NCBI-ID: 38018 / 生物種: Bacteriophage sp. / Sci species strain: YSD1 / ウイルスタイプ: VIRION / ウイルス・単離状態: SUBSPECIES / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:   Salmonella enterica subsp. enterica serovar Typhi (サルモネラ菌) Salmonella enterica subsp. enterica serovar Typhi (サルモネラ菌) |
| 分子量 | 理論値: 22.8 MDa |
| ウイルス殻 | Shell ID: 1 / 名称: YSD1 capsid / 直径: 650.0 Å / T番号(三角分割数): 7 |
-分子 #1: YSD1_17
| 分子 | 名称: YSD1_17 / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Bacteriophage sp. (ファージ) Bacteriophage sp. (ファージ) |
| 分子量 | 理論値: 39.945598 KDa |
| 配列 | 文字列: MAGLYTTYQL LEVQRKLKTL PAFFLQWFPR QINFQEDMIA FDKVIQDVTR VAPFVAPNVQ GRVIKESGYN TKTFKPAYVK PKHVIDPNM IIPRQPGEAL GTGTLSIAQR RDRVIAYLLM KHRAMHENTW EWMAAQAAQY GYVDVQGQDY PLVRVDFGRD A ALTMTTDW ...文字列: MAGLYTTYQL LEVQRKLKTL PAFFLQWFPR QINFQEDMIA FDKVIQDVTR VAPFVAPNVQ GRVIKESGYN TKTFKPAYVK PKHVIDPNM IIPRQPGEAL GTGTLSIAQR RDRVIAYLLM KHRAMHENTW EWMAAQAAQY GYVDVQGQDY PLVRVDFGRD A ALTMTTDW TAAGVTLMDM IADLRDGQRL VSDKSMSGTV IRDYVFGGDA WDQFVKVGGK ELWGKDGLMD STIRGSETNV TR LWDDVEG VQYMGELVGA NGAGRMRIWV NTQKYRDQND QEQFLMKQKA VMGISSAIEG VRCFGAILDK GAGYQALDYF PKM WDQEDP SVEYLMSQGA PLMVPADPNA SFLLTVMS UniProtKB: Major capsid protein |
-分子 #2: YSD1_16
| 分子 | 名称: YSD1_16 / タイプ: protein_or_peptide / ID: 2 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Bacteriophage sp. (ファージ) Bacteriophage sp. (ファージ) |
| 分子量 | 理論値: 14.401047 KDa |
| 配列 | 文字列: MNLLTMMAAT SLPNYLAGNG DLGSWEPTQI FAGEADIVTE GGAAGADIEI YQVIAKNAAG AMVPHDPTAT TGTSPDEVPA PQSVAIGIA AQPAKSGQNV PYYIGGVFNH AALGWHASLD TLAKRQAVFD RTNIHIGNLY UniProtKB: Putative+head+decorative+protein |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: The grid was blotted for 2 seconds with a blot force of -3 and no drain time.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 最大 デフォーカス(補正後): 2.5 µm / 最小 デフォーカス(補正後): 0.5 µm / 倍率(補正後): 105000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-30 / 撮影したグリッド数: 1 / 実像数: 1881 / 平均露光時間: 12.0 sec. / 平均電子線量: 27.24 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z
Z Y
Y X
X