+検索条件
-Structure paper
| タイトル | Bitter taste receptor activation by cholesterol and an intracellular tastant. |
|---|---|
| ジャーナル・号・ページ | Nature, Vol. 628, Issue 8008, Page 664-671, Year 2024 |
| 掲載日 | 2024年4月10日 |
 著者 著者 | Yoojoong Kim / Ryan H Gumpper / Yongfeng Liu / D Dewran Kocak / Yan Xiong / Can Cao / Zhijie Deng / Brian E Krumm / Manish K Jain / Shicheng Zhang / Jian Jin / Bryan L Roth /   |
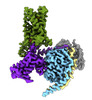
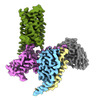
| PubMed 要旨 | Bitter taste sensing is mediated by type 2 taste receptors (TAS2Rs (also known as T2Rs)), which represent a distinct class of G-protein-coupled receptors. Among the 26 members of the TAS2Rs, TAS2R14 ...Bitter taste sensing is mediated by type 2 taste receptors (TAS2Rs (also known as T2Rs)), which represent a distinct class of G-protein-coupled receptors. Among the 26 members of the TAS2Rs, TAS2R14 is highly expressed in extraoral tissues and mediates the responses to more than 100 structurally diverse tastants, although the molecular mechanisms for recognizing diverse chemicals and initiating cellular signalling are still poorly understood. Here we report two cryo-electron microscopy structures for TAS2R14 complexed with G (also known as gustducin) and G. Both structures have an orthosteric binding pocket occupied by endogenous cholesterol as well as an intracellular allosteric site bound by the bitter tastant cmpd28.1, including a direct interaction with the α5 helix of G and G. Computational and biochemical studies validate both ligand interactions. Our functional analysis identified cholesterol as an orthosteric agonist and the bitter tastant cmpd28.1 as a positive allosteric modulator with direct agonist activity at TAS2R14. Moreover, the orthosteric pocket is connected to the allosteric site via an elongated cavity, which has a hydrophobic core rich in aromatic residues. Our findings provide insights into the ligand recognition of bitter taste receptors and suggest activities of TAS2R14 beyond bitter taste perception via intracellular allosteric tastants. |
 リンク リンク |  Nature / Nature /  PubMed:38600377 PubMed:38600377 |
| 手法 | EM (単粒子) |
| 解像度 | 2.68 - 3.3 Å |
| 構造データ | EMDB-43647, PDB-8vy7: EMDB-43650, PDB-8vy9:  EMDB-43656: CryoEM structure of Gi-coupled TAS2R14 with cholesterol and an intracellular tastant (Locally refined map)  EMDB-43657: CryoEM structure of Ggust-coupled TAS2R14 with cholesterol and an intracellular tastant (Locally refined map) |
| 化合物 |  PDB-1aei:  ChemComp-CLR: |
| 由来 |
|
 キーワード キーワード |  SIGNALING PROTEIN / SIGNALING PROTEIN /  GPCR (Gタンパク質共役受容体) / GPCR (Gタンパク質共役受容体) /  Complex / Complex /  Taste receptor Taste receptor |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について