+検索条件
-Structure paper
| タイトル | Structures of the human LONP1 protease reveal regulatory steps involved in protease activation. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 12, Issue 1, Page 3239, Year 2021 |
| 掲載日 | 2021年5月28日 |
 著者 著者 | Mia Shin / Edmond R Watson / Albert S Song / Jeffrey T Mindrebo / Scott J Novick / Patrick R Griffin / R Luke Wiseman / Gabriel C Lander /  |
| PubMed 要旨 | The human mitochondrial AAA+ protein LONP1 is a critical quality control protease involved in regulating diverse aspects of mitochondrial biology including proteostasis, electron transport chain ...The human mitochondrial AAA+ protein LONP1 is a critical quality control protease involved in regulating diverse aspects of mitochondrial biology including proteostasis, electron transport chain activity, and mitochondrial transcription. As such, genetic or aging-associated imbalances in LONP1 activity are implicated in pathologic mitochondrial dysfunction associated with numerous human diseases. Despite this importance, the molecular basis for LONP1-dependent proteolytic activity remains poorly defined. Here, we solved cryo-electron microscopy structures of human LONP1 to reveal the underlying molecular mechanisms governing substrate proteolysis. We show that, like bacterial Lon, human LONP1 adopts both an open and closed spiral staircase orientation dictated by the presence of substrate and nucleotide. Unlike bacterial Lon, human LONP1 contains a second spiral staircase within its ATPase domain that engages substrate as it is translocated toward the proteolytic chamber. Intriguingly, and in contrast to its bacterial ortholog, substrate binding within the central ATPase channel of LONP1 alone is insufficient to induce the activated conformation of the protease domains. To successfully induce the active protease conformation in substrate-bound LONP1, substrate binding within the protease active site is necessary, which we demonstrate by adding bortezomib, a peptidomimetic active site inhibitor of LONP1. These results suggest LONP1 can decouple ATPase and protease activities depending on whether AAA+ or both AAA+ and protease domains bind substrate. Importantly, our structures provide a molecular framework to define the critical importance of LONP1 in regulating mitochondrial proteostasis in health and disease. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:34050165 / PubMed:34050165 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.2 - 4.8 Å |
| 構造データ | EMDB-23013, PDB-7krz: EMDB-23019, PDB-7ksl: EMDB-23020, PDB-7ksm:  EMDB-23320: |
| 化合物 |  ChemComp-ATP:  ChemComp-MG: 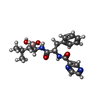 ChemComp-BO2:  ChemComp-ADP: |
| 由来 |
|
 キーワード キーワード |  HYDROLASE (加水分解酵素) / HYDROLASE (加水分解酵素) /  AAA+ / AAA+ /  ATPase (ATPアーゼ) / ATPase (ATPアーゼ) /  protease (プロテアーゼ) / protease (プロテアーゼ) /  mitochondrial (ミトコンドリア) / mitochondrial (ミトコンドリア) /  LONP1 / LON LONP1 / LON |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について











