+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7pdz | ||||||
|---|---|---|---|---|---|---|---|
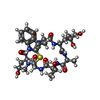
| タイトル | Structure of capping protein bound to the barbed end of a cytoplasmic actin filament | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  STRUCTURAL PROTEIN (タンパク質) / STRUCTURAL PROTEIN (タンパク質) /  Cytoskeleton (細胞骨格) / cell-shape remodelling / barbed end Cytoskeleton (細胞骨格) / cell-shape remodelling / barbed end | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoskeletal calyx / Adherens junctions interactions / Cell-extracellular matrix interactions / RHOF GTPase cycle / Advanced glycosylation endproduct receptor signaling / RHOBTB2 GTPase cycle / RHOD GTPase cycle / Gap junction degradation / Formation of annular gap junctions / MAP2K and MAPK activation ...cytoskeletal calyx / Adherens junctions interactions / Cell-extracellular matrix interactions / RHOF GTPase cycle / Advanced glycosylation endproduct receptor signaling / RHOBTB2 GTPase cycle / RHOD GTPase cycle / Gap junction degradation / Formation of annular gap junctions / MAP2K and MAPK activation / EPHB-mediated forward signaling / Regulation of actin dynamics for phagocytic cup formation / RHO GTPases Activate WASPs and WAVEs / COPI-independent Golgi-to-ER retrograde traffic / RHO GTPases activate IQGAPs / RHO GTPases Activate Formins / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / WASH complex / sperm connecting piece / F-actin capping protein complex / COPI-mediated anterograde transport / negative regulation of filopodium assembly / structural constituent of postsynaptic actin cytoskeleton / VEGFA-VEGFR2 Pathway / dense body / Factors involved in megakaryocyte development and platelet production /  Clathrin-mediated endocytosis / cell projection organization / Clathrin-mediated endocytosis / cell projection organization /  cell junction assembly / MHC class II antigen presentation / barbed-end actin filament capping / actin polymerization or depolymerization / regulation of cell morphogenesis / cell junction assembly / MHC class II antigen presentation / barbed-end actin filament capping / actin polymerization or depolymerization / regulation of cell morphogenesis /  regulation of lamellipodium assembly / regulation of lamellipodium assembly /  NuA4 histone acetyltransferase complex / NuA4 histone acetyltransferase complex /  lamellipodium assembly / cortical cytoskeleton / lamellipodium assembly / cortical cytoskeleton /  刷子縁 / asymmetric synapse / cytoskeleton organization / hippocampal mossy fiber to CA3 synapse / 刷子縁 / asymmetric synapse / cytoskeleton organization / hippocampal mossy fiber to CA3 synapse /  軸索誘導 / 軸索誘導 /  運動性 / 運動性 /  マイクロフィラメント / マイクロフィラメント /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / Schaffer collateral - CA1 synapse / cell morphogenesis / Z disc / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / Schaffer collateral - CA1 synapse / cell morphogenesis / Z disc /  actin filament binding / cell-cell junction / actin filament binding / cell-cell junction /  マイクロフィラメント / マイクロフィラメント /  lamellipodium / lamellipodium /  actin binding / actin cytoskeleton organization / actin binding / actin cytoskeleton organization /  樹状突起スパイン / 樹状突起スパイン /  postsynaptic density / postsynaptic density /  細胞骨格 / 細胞骨格 /  hydrolase activity / hydrolase activity /  神経繊維 / 神経繊維 /  focal adhesion / neuronal cell body / focal adhesion / neuronal cell body /  シナプス / シナプス /  protein kinase binding / protein-containing complex / protein kinase binding / protein-containing complex /  ATP binding / ATP binding /  生体膜 / 生体膜 /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ)  Bos taurus (ウシ) Bos taurus (ウシ)synthetic construct (人工物) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.8 Å クライオ電子顕微鏡法 / 解像度: 3.8 Å | ||||||
 データ登録者 データ登録者 | Funk, J. / Merino, F. / Schacks, M. / Rottner, K. / Raunser, S. / Bieling, P. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: A barbed end interference mechanism reveals how capping protein promotes nucleation in branched actin networks. 著者: Johanna Funk / Felipe Merino / Matthias Schaks / Klemens Rottner / Stefan Raunser / Peter Bieling /  要旨: Heterodimeric capping protein (CP/CapZ) is an essential factor for the assembly of branched actin networks, which push against cellular membranes to drive a large variety of cellular processes. Aside ...Heterodimeric capping protein (CP/CapZ) is an essential factor for the assembly of branched actin networks, which push against cellular membranes to drive a large variety of cellular processes. Aside from terminating filament growth, CP potentiates the nucleation of actin filaments by the Arp2/3 complex in branched actin networks through an unclear mechanism. Here, we combine structural biology with in vitro reconstitution to demonstrate that CP not only terminates filament elongation, but indirectly stimulates the activity of Arp2/3 activating nucleation promoting factors (NPFs) by preventing their association to filament barbed ends. Key to this function is one of CP's C-terminal "tentacle" extensions, which sterically masks the main interaction site of the terminal actin protomer. Deletion of the β tentacle only modestly impairs capping. However, in the context of a growing branched actin network, its removal potently inhibits nucleation promoting factors by tethering them to capped filament ends. End tethering of NPFs prevents their loading with actin monomers required for activation of the Arp2/3 complex and thus strongly inhibits branched network assembly both in cells and reconstituted motility assays. Our results mechanistically explain how CP couples two opposed processes-capping and nucleation-in branched actin network assembly. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7pdz.cif.gz 7pdz.cif.gz | 481.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7pdz.ent.gz pdb7pdz.ent.gz | 410.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7pdz.json.gz 7pdz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pd/7pdz https://data.pdbj.org/pub/pdb/validation_reports/pd/7pdz ftp://data.pdbj.org/pub/pdb/validation_reports/pd/7pdz ftp://data.pdbj.org/pub/pdb/validation_reports/pd/7pdz | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 3種, 8分子 EFIJKLNO
| #1: タンパク質 | 分子量: 30669.768 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 遺伝子: Capzb, Cappb1 / 発現宿主: Mus musculus (ハツカネズミ) / 遺伝子: Capzb, Cappb1 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P47757 Escherichia coli (大腸菌) / 参照: UniProt: P47757 |
|---|---|
| #2: タンパク質 | 分子量: 32980.703 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 遺伝子: Capza1, Cappa1 / 発現宿主: Mus musculus (ハツカネズミ) / 遺伝子: Capza1, Cappa1 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P47753 Escherichia coli (大腸菌) / 参照: UniProt: P47753 |
| #3: タンパク質 |  アクチン / Beta-actin アクチン / Beta-actin分子量: 41795.680 Da / 分子数: 6 / 由来タイプ: 天然 / 由来: (天然)   Bos taurus (ウシ) / 参照: UniProt: P60712 Bos taurus (ウシ) / 参照: UniProt: P60712 |
-タンパク質・ペプチド , 1種, 5分子 QRSTP
| #4: タンパク質・ペプチド |  / /  |
|---|
-非ポリマー , 3種, 16分子 




| #5: 化合物 | ChemComp-ADP /  アデノシン二リン酸 アデノシン二リン酸#6: 化合物 | ChemComp-MG / #7: 化合物 | ChemComp-PO4 /  リン酸塩 リン酸塩 |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Complex between capping protein and the barbed end of cytoplasmic actin filaments タイプ: COMPLEX / Entity ID: #1-#4 / 由来: MULTIPLE SOURCES | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 実験値: NO | |||||||||||||||||||||||||
| 緩衝液 | pH: 7 / 詳細: KMEI buffer | |||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | |||||||||||||||||||||||||
| 試料支持 | 詳細: Mild discharging with 5 mA current / グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R1.2/1.3 | |||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 286 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / Cs Bright-field microscopy / Cs : 2.7 mm / アライメント法: COMA FREE : 2.7 mm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 平均露光時間: 3 sec. / 電子線照射量: 60 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 撮影したグリッド数: 2 / 実像数: 4204 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 570724 | ||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 60206 / アルゴリズム: BACK PROJECTION / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 40 / プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 5ADX |
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj