+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6r23 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
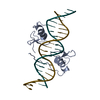
| タイトル | The structure of a Ty3 retrotransposon capsid C-terminal domain dimer | |||||||||
 要素 要素 | Transposon Ty3-I Gag-Pol polyprotein | |||||||||
 キーワード キーワード |  VIRUS LIKE PARTICLE (ウイルス様粒子) / Ty3 / VIRUS LIKE PARTICLE (ウイルス様粒子) / Ty3 /  retrotransposon (レトロトランスポゾン) / retrotransposon (レトロトランスポゾン) /  retrovirus (レトロウイルス科) / retrovirus (レトロウイルス科) /  capsid (カプシド) / capsid (カプシド) /  Gag polyprotein / capsid-CTD Gag polyprotein / capsid-CTD | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報retrotransposon nucleocapsid /  トランスポゾン / トランスポゾン /  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ /  リボヌクレアーゼH / RNA nuclease activity / DNA integration / リボヌクレアーゼH / RNA nuclease activity / DNA integration /  逆転写酵素 / 逆転写酵素 /  RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity / RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity /  peptidase activity ...retrotransposon nucleocapsid / peptidase activity ...retrotransposon nucleocapsid /  トランスポゾン / トランスポゾン /  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ /  リボヌクレアーゼH / RNA nuclease activity / DNA integration / リボヌクレアーゼH / RNA nuclease activity / DNA integration /  逆転写酵素 / 逆転写酵素 /  RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity / RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity /  peptidase activity / DNA recombination / peptidase activity / DNA recombination /  DNAポリメラーゼ / aspartic-type endopeptidase activity / DNAポリメラーゼ / aspartic-type endopeptidase activity /  DNA-directed DNA polymerase activity / DNA-directed DNA polymerase activity /  タンパク質分解 / タンパク質分解 /  DNA binding / DNA binding /  RNA binding / zinc ion binding / RNA binding / zinc ion binding /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | |||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.9 Å クライオ電子顕微鏡法 / 解像度: 4.9 Å | |||||||||
 データ登録者 データ登録者 | Dodonova, S.O. / Prinz, S. / Bilanchone, V. / Sandmeyer, S. / Briggs, J.A.G. | |||||||||
| 資金援助 |  ドイツ, ドイツ,  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2019 ジャーナル: Proc Natl Acad Sci U S A / 年: 2019タイトル: Structure of the Ty3/Gypsy retrotransposon capsid and the evolution of retroviruses. 著者: Svetlana O Dodonova / Simone Prinz / Virginia Bilanchone / Suzanne Sandmeyer / John A G Briggs /    要旨: Retroviruses evolved from long terminal repeat (LTR) retrotransposons by acquisition of envelope functions, and subsequently reinvaded host genomes. Together, endogenous retroviruses and LTR ...Retroviruses evolved from long terminal repeat (LTR) retrotransposons by acquisition of envelope functions, and subsequently reinvaded host genomes. Together, endogenous retroviruses and LTR retrotransposons represent major components of animal, plant, and fungal genomes. Sequences from these elements have been exapted to perform essential host functions, including placental development, synaptic communication, and transcriptional regulation. They encode a Gag polypeptide, the capsid domains of which can oligomerize to form a virus-like particle. The structures of retroviral capsids have been extensively described. They assemble an immature viral particle through oligomerization of full-length Gag. Proteolytic cleavage of Gag results in a mature, infectious particle. In contrast, the absence of structural data on LTR retrotransposon capsids hinders our understanding of their function and evolutionary relationships. Here, we report the capsid morphology and structure of the archetypal Gypsy retrotransposon Ty3. We performed electron tomography (ET) of immature and mature Ty3 particles within cells. We found that, in contrast to retroviruses, these do not change size or shape upon maturation. Cryo-ET and cryo-electron microscopy of purified, immature Ty3 particles revealed an irregular fullerene geometry previously described for mature retrovirus core particles and a tertiary and quaternary arrangement of the capsid (CA) C-terminal domain within the assembled capsid that is conserved with mature HIV-1. These findings provide a structural basis for studying retrotransposon capsids, including those domesticated in higher organisms. They suggest that assembly via a structurally distinct immature capsid is a later retroviral adaptation, while the structure of mature assembled capsids is conserved between LTR retrotransposons and retroviruses. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6r23.cif.gz 6r23.cif.gz | 48.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6r23.ent.gz pdb6r23.ent.gz | 33.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6r23.json.gz 6r23.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/r2/6r23 https://data.pdbj.org/pub/pdb/validation_reports/r2/6r23 ftp://data.pdbj.org/pub/pdb/validation_reports/r2/6r23 ftp://data.pdbj.org/pub/pdb/validation_reports/r2/6r23 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 36382.371 Da / 分子数: 2 / 変異: D336I / 由来タイプ: 組換発現 詳細: D336I mutation in the active center of the Ty3 protease 由来: (組換発現)   Saccharomyces cerevisiae (strain ATCC 204508 / S288c) (パン酵母) Saccharomyces cerevisiae (strain ATCC 204508 / S288c) (パン酵母)株: ATCC 204508 / S288c / 遺伝子: TY3B-I, YILWTy3-1 POL, YIL082W-A / プラスミド: pJK776 / 発現宿主:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母)株 (発現宿主): strain yVB1680 strain - BY4741 killer minus, Ty3 null 参照: UniProt: Q7LHG5,  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ, 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ,  逆転写酵素, 逆転写酵素,  DNAポリメラーゼ, DNAポリメラーゼ,  リボヌクレアーゼH リボヌクレアーゼH |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Ty3 capsid C-terminal domain dimer / タイプ: COMPLEX 詳細: The 9 non-symmetry related copies of the Ty3 Capsid-CTD from the complete capsid shell structure were aligned and averaged to generate a higher resolution 4.9 A structure Entity ID: all / 由来: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| ||||||||||||||||||||
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | ||||||||||||||||||||
| 由来(組換発現) | 生物種:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | ||||||||||||||||||||
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: OTHER / タイプ: VIRUS-LIKE PARTICLE | ||||||||||||||||||||
| 天然宿主 | 生物種: Saccharomyces cerevisiae | ||||||||||||||||||||
| ウイルス殻 | 名称: GAG Capsid / 直径: 480 nm / 三角数 (T数): 9 | ||||||||||||||||||||
| 緩衝液 | pH: 8 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: C-flat | ||||||||||||||||||||
急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE / 湿度: 85 % / 凍結前の試料温度: 296 K 詳細: The sample was applied onto glow-discharged C-flat (Protochips Inc.) holey carbon grids. The grids were blotted from the back side for 11 seconds at room temperature in a chamber at 85% ...詳細: The sample was applied onto glow-discharged C-flat (Protochips Inc.) holey carbon grids. The grids were blotted from the back side for 11 seconds at room temperature in a chamber at 85% humidity and plunge-frozen into liquid ethane using a manual plunger. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS 詳細: Cryo-grids containing purified PR- Ty3 particles were imaged in a Titan Krios electron microscope equipped with a Falcon II direct electron detector, operated at 300 kV. Images were collected ...詳細: Cryo-grids containing purified PR- Ty3 particles were imaged in a Titan Krios electron microscope equipped with a Falcon II direct electron detector, operated at 300 kV. Images were collected with a nominal magnification of 75000, giving a pixel size of 1.08 A. Images were collected in integrating mode with a total electron dose of 20 e/A2. The range of applied defocus values was between -1.0 um and -3.5 um. |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 75000 X / 最大 デフォーカス(公称値): 3500 nm / 最小 デフォーカス(公称値): 1000 nm / Cs Bright-field microscopy / 倍率(公称値): 75000 X / 最大 デフォーカス(公称値): 3500 nm / 最小 デフォーカス(公称値): 1000 nm / Cs : 2.7 mm / C2レンズ絞り径: 50 µm : 2.7 mm / C2レンズ絞り径: 50 µm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 20 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 撮影したグリッド数: 1 |
| 画像スキャン | 動画フレーム数/画像: 1 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1727 | ||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 4.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 74160 詳細: The Ty3 particles have a T=9 and each asymmetric unit of the lattice contains nine non-symmetry related Ty3 capsid protein monomers. We extracted all non-symmetry related units from the final ...詳細: The Ty3 particles have a T=9 and each asymmetric unit of the lattice contains nine non-symmetry related Ty3 capsid protein monomers. We extracted all non-symmetry related units from the final reconstructions from the two half datasets. The CA-CTDs were aligned and averaged separately. The final structure of the CA-CTD comes from nine averaged copies of the domain. The final structure of the CA-CTD was resolved at 4.9 A resolution at 0.143 FSC. Gaussian-smoothened ellipsoid-shaped masks were used for resolution measurements. クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| EM volume selection | 詳細: 1733 vesicles and near-complete buds were picked from 61 tomograms. Subtomograms were extracted from the surface of the vesicles. Num. of tomograms: 54 / Num. of volumes extracted: 2547 | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL / Target criteria: Cross-correlation coefficient |
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj
