+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6qkz | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Full length GluA1/2-gamma8 complex | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  AMPAR / AMPAR /  ion channel (イオンチャネル) / GluA1 / GluA2 / tarp ion channel (イオンチャネル) / GluA1 / GluA2 / tarp | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Phase 2 - plateau phase / Phase 0 - rapid depolarisation / Cargo concentration in the ER / cellular response to amine stimulus / axonal spine / COPII-mediated vesicle transport / positive regulation of membrane potential / chemical synaptic transmission, postsynaptic / cellular response to ammonium ion / neurotransmitter receptor transport, postsynaptic endosome to lysosome ...Phase 2 - plateau phase / Phase 0 - rapid depolarisation / Cargo concentration in the ER / cellular response to amine stimulus / axonal spine / COPII-mediated vesicle transport / positive regulation of membrane potential / chemical synaptic transmission, postsynaptic / cellular response to ammonium ion / neurotransmitter receptor transport, postsynaptic endosome to lysosome /  L-type voltage-gated calcium channel complex / neurotransmitter receptor activity involved in regulation of postsynaptic cytosolic calcium ion concentration / LGI-ADAM interactions / neuron spine / L-type voltage-gated calcium channel complex / neurotransmitter receptor activity involved in regulation of postsynaptic cytosolic calcium ion concentration / LGI-ADAM interactions / neuron spine /  myosin V binding / Trafficking of AMPA receptors / myosin V binding / Trafficking of AMPA receptors /  regulation of AMPA receptor activity / neurotransmitter receptor internalization / channel regulator activity / protein phosphatase 2B binding / dendritic spine membrane / postsynaptic neurotransmitter receptor diffusion trapping / response to arsenic-containing substance / cellular response to dsRNA / Synaptic adhesion-like molecules / long-term synaptic depression / regulation of AMPA receptor activity / neurotransmitter receptor internalization / channel regulator activity / protein phosphatase 2B binding / dendritic spine membrane / postsynaptic neurotransmitter receptor diffusion trapping / response to arsenic-containing substance / cellular response to dsRNA / Synaptic adhesion-like molecules / long-term synaptic depression /  beta-2 adrenergic receptor binding / beta-2 adrenergic receptor binding /  protein kinase A binding / cellular response to peptide hormone stimulus / neuronal cell body membrane / spine synapse / spinal cord development / dendritic spine neck / dendritic spine head / Activation of AMPA receptors / response to lithium ion / perisynaptic space / cellular response to glycine / transmission of nerve impulse / AMPA glutamate receptor activity / regulation of postsynaptic membrane neurotransmitter receptor levels / Trafficking of GluR2-containing AMPA receptors / protein kinase A binding / cellular response to peptide hormone stimulus / neuronal cell body membrane / spine synapse / spinal cord development / dendritic spine neck / dendritic spine head / Activation of AMPA receptors / response to lithium ion / perisynaptic space / cellular response to glycine / transmission of nerve impulse / AMPA glutamate receptor activity / regulation of postsynaptic membrane neurotransmitter receptor levels / Trafficking of GluR2-containing AMPA receptors /  immunoglobulin binding / calcium channel regulator activity / AMPA glutamate receptor complex / neuronal action potential / kainate selective glutamate receptor activity / immunoglobulin binding / calcium channel regulator activity / AMPA glutamate receptor complex / neuronal action potential / kainate selective glutamate receptor activity /  excitatory synapse / excitatory synapse /  ionotropic glutamate receptor complex / extracellularly glutamate-gated ion channel activity / ionotropic glutamate receptor complex / extracellularly glutamate-gated ion channel activity /  adenylate cyclase binding / cellular response to organic cyclic compound / asymmetric synapse / G-protein alpha-subunit binding / regulation of receptor recycling / Unblocking of NMDA receptors, glutamate binding and activation / adenylate cyclase binding / cellular response to organic cyclic compound / asymmetric synapse / G-protein alpha-subunit binding / regulation of receptor recycling / Unblocking of NMDA receptors, glutamate binding and activation /  voltage-gated calcium channel activity / regulation of postsynaptic membrane potential / voltage-gated calcium channel activity / regulation of postsynaptic membrane potential /  long-term memory / long-term memory /  glutamate receptor binding / positive regulation of synaptic transmission / response to electrical stimulus / presynaptic active zone membrane / glutamate-gated receptor activity / response to fungicide / glutamate receptor binding / positive regulation of synaptic transmission / response to electrical stimulus / presynaptic active zone membrane / glutamate-gated receptor activity / response to fungicide /  regulation of synaptic transmission, glutamatergic / cellular response to brain-derived neurotrophic factor stimulus / somatodendritic compartment / regulation of synaptic transmission, glutamatergic / cellular response to brain-derived neurotrophic factor stimulus / somatodendritic compartment /  synapse assembly / dendrite membrane / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / synapse assembly / dendrite membrane / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential /  ionotropic glutamate receptor binding / ionotropic glutamate receptor binding /  cytoskeletal protein binding / ionotropic glutamate receptor signaling pathway / dendrite cytoplasm / monoatomic ion transmembrane transport / positive regulation of synaptic transmission, glutamatergic / cytoskeletal protein binding / ionotropic glutamate receptor signaling pathway / dendrite cytoplasm / monoatomic ion transmembrane transport / positive regulation of synaptic transmission, glutamatergic /  SNARE binding / response to cocaine / dendritic shaft / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / SNARE binding / response to cocaine / dendritic shaft / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential /  synaptic membrane / synaptic membrane /  synaptic transmission, glutamatergic / synaptic transmission, glutamatergic /  PDZ domain binding / postsynaptic density membrane / cellular response to amino acid stimulus / protein tetramerization / PDZ domain binding / postsynaptic density membrane / cellular response to amino acid stimulus / protein tetramerization /  regulation of synaptic plasticity / modulation of chemical synaptic transmission / regulation of synaptic plasticity / modulation of chemical synaptic transmission /  neuromuscular junction / Schaffer collateral - CA1 synapse / establishment of protein localization / neuromuscular junction / Schaffer collateral - CA1 synapse / establishment of protein localization /  terminal bouton / terminal bouton /  receptor internalization / synaptic vesicle membrane / response to organic cyclic compound / cerebral cortex development / response to peptide hormone / response to toxic substance / cellular response to growth factor stimulus receptor internalization / synaptic vesicle membrane / response to organic cyclic compound / cerebral cortex development / response to peptide hormone / response to toxic substance / cellular response to growth factor stimulus類似検索 - 分子機能 | |||||||||
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) | |||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 6.3 Å クライオ電子顕微鏡法 / 解像度: 6.3 Å | |||||||||
 データ登録者 データ登録者 | Herguedas, B. / Garcia-Nafria, J. / Greger, I.G. | |||||||||
 引用 引用 |  ジャーナル: Science / 年: 2019 ジャーナル: Science / 年: 2019タイトル: Architecture of the heteromeric GluA1/2 AMPA receptor in complex with the auxiliary subunit TARP γ8. 著者: Beatriz Herguedas / Jake F Watson / Hinze Ho / Ondrej Cais / Javier García-Nafría / Ingo H Greger /  要旨: AMPA-type glutamate receptors (AMPARs) mediate excitatory neurotransmission and are central regulators of synaptic plasticity, a molecular mechanism underlying learning and memory. Although AMPARs ...AMPA-type glutamate receptors (AMPARs) mediate excitatory neurotransmission and are central regulators of synaptic plasticity, a molecular mechanism underlying learning and memory. Although AMPARs act predominantly as heteromers, structural studies have focused on homomeric assemblies. Here, we present a cryo-electron microscopy structure of the heteromeric GluA1/2 receptor associated with two transmembrane AMPAR regulatory protein (TARP) γ8 auxiliary subunits, the principal AMPAR complex at hippocampal synapses. Within the receptor, the core subunits arrange to give the GluA2 subunit dominant control of gating. This structure reveals the geometry of the Q/R site that controls calcium flux, suggests association of TARP-stabilized lipids, and demonstrates that the extracellular loop of γ8 modulates gating by selectively interacting with the GluA2 ligand-binding domain. Collectively, this structure provides a blueprint for deciphering the signal transduction mechanisms of synaptic AMPARs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6qkz.cif.gz 6qkz.cif.gz | 442.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6qkz.ent.gz pdb6qkz.ent.gz | 274.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6qkz.json.gz 6qkz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qk/6qkz https://data.pdbj.org/pub/pdb/validation_reports/qk/6qkz ftp://data.pdbj.org/pub/pdb/validation_reports/qk/6qkz ftp://data.pdbj.org/pub/pdb/validation_reports/qk/6qkz | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 3種, 6分子 ACBDIJ
| #1: タンパク質 | 分子量: 100739.602 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Rattus norvegicus (ドブネズミ) / 発現宿主: Rattus norvegicus (ドブネズミ) / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P19490 Homo sapiens (ヒト) / 参照: UniProt: P19490#2: タンパク質 |  GRIA2 / GluR-2 / AMPA-selective glutamate receptor 2 / GluR-B / GluR-K2 / Glutamate receptor ionotropic / ...GluR-2 / AMPA-selective glutamate receptor 2 / GluR-B / GluR-K2 / Glutamate receptor ionotropic / AMPA 2 / GluA2 GRIA2 / GluR-2 / AMPA-selective glutamate receptor 2 / GluR-B / GluR-K2 / Glutamate receptor ionotropic / ...GluR-2 / AMPA-selective glutamate receptor 2 / GluR-B / GluR-K2 / Glutamate receptor ionotropic / AMPA 2 / GluA2分子量: 93880.078 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Rattus norvegicus (ドブネズミ) / 遺伝子: Gria2, Glur2 / 発現宿主: Rattus norvegicus (ドブネズミ) / 遺伝子: Gria2, Glur2 / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P19491 Homo sapiens (ヒト) / 参照: UniProt: P19491#3: タンパク質 | 分子量: 43592.008 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Rattus norvegicus (ドブネズミ) / 遺伝子: Cacng8 / 発現宿主: Rattus norvegicus (ドブネズミ) / 遺伝子: Cacng8 / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: Q8VHW5 Homo sapiens (ヒト) / 参照: UniProt: Q8VHW5 |
|---|
-糖 , 3種, 10分子 
| #4: 多糖 |  オリゴ糖 / 分子量: 586.542 Da / 分子数: 2 / 由来タイプ: 組換発現 オリゴ糖 / 分子量: 586.542 Da / 分子数: 2 / 由来タイプ: 組換発現#5: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose  オリゴ糖 / 分子量: 424.401 Da / 分子数: 6 / 由来タイプ: 組換発現 オリゴ糖 / 分子量: 424.401 Da / 分子数: 6 / 由来タイプ: 組換発現#7: 糖 |  N-アセチルグルコサミン N-アセチルグルコサミン |
|---|
-非ポリマー , 1種, 4分子 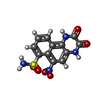
| #6: 化合物 | ChemComp-E2Q /  NBQX NBQX |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: GluA1/A2 bound to gamma-8 / タイプ: COMPLEX / Entity ID: #1-#3 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 447 kDa/nm / 実験値: NO |
| 由来(天然) | 生物種:   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
| 由来(組換発現) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 8 詳細: 25 mM TRIS, pH 8, 150 mM NaCl and 0.1 % digitonin (w/v) |
| 試料 | 濃度: 0.4 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K 詳細: 3uL on grid, 60 sec incubation and 4sec blotting time |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): -900 nm / 最小 デフォーカス(公称値): -200 nm / Cs Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): -900 nm / 最小 デフォーカス(公称値): -200 nm / Cs : 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE : 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER 最高温度: 100 K / 最低温度: 100 K |
| 撮影 | 平均露光時間: 14 sec. / 電子線照射量: 32 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 3 / 実像数: 5005 |
| 電子光学装置 | エネルギーフィルタースリット幅: 20 eV / 位相板: VOLTA PHASE PLATE |
| 画像スキャン | 横: 3838 / 縦: 3710 / 動画フレーム数/画像: 35 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C2 (2回回転対称 : C2 (2回回転対称 ) ) | ||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 6.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 183881 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL | ||||||||||||||||||||||||||||||||
| 原子モデル構築 |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj









