登録情報 データベース : PDB / ID : 6pz9タイトル Cryo-EM structure of the pancreatic beta-cell SUR1 bound to ATP and repaglinide ATP-binding cassette sub-family C member 8 ATP-sensitive inward rectifier potassium channel 11 キーワード / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Cricetus cricetus (クロハラハムスクー)Rattus norvegicus (ドブネズミ)手法 / / / 解像度 : 3.65 Å データ登録者 Shyng, S.L. / Yoshioka, C. / Martin, G.M. / Sung, M.W. 資金援助 組織 認可番号 国 National Institutes of Health/National Institute of Diabetes and Digestive and Kidney Disease (NIH/NIDDK)
ジャーナル : Elife / 年 : 2019タイトル : Mechanism of pharmacochaperoning in a mammalian K channel revealed by cryo-EM.著者 : Gregory M Martin / Min Woo Sung / Zhongying Yang / Laura M Innes / Balamurugan Kandasamy / Larry L David / Craig Yoshioka / Show-Ling Shyng / 要旨 : ATP-sensitive potassium (K) channels composed of a pore-forming Kir6.2 potassium channel and a regulatory ABC transporter sulfonylurea receptor 1 (SUR1) regulate insulin secretion in pancreatic β- ... ATP-sensitive potassium (K) channels composed of a pore-forming Kir6.2 potassium channel and a regulatory ABC transporter sulfonylurea receptor 1 (SUR1) regulate insulin secretion in pancreatic β-cells to maintain glucose homeostasis. Mutations that impair channel folding or assembly prevent cell surface expression and cause congenital hyperinsulinism. Structurally diverse K inhibitors are known to act as pharmacochaperones to correct mutant channel expression, but the mechanism is unknown. Here, we compare cryoEM structures of a mammalian K channel bound to pharmacochaperones glibenclamide, repaglinide, and carbamazepine. We found all three drugs bind within a common pocket in SUR1. Further, we found the N-terminus of Kir6.2 inserted within the central cavity of the SUR1 ABC core, adjacent the drug binding pocket. The findings reveal a common mechanism by which diverse compounds stabilize the Kir6.2 N-terminus within SUR1's ABC core, allowing it to act as a firm 'handle' for the assembly of metastable mutant SUR1-Kir6.2 complexes. 履歴 登録 2019年7月31日 登録サイト / 処理サイト 改定 1.0 2019年8月14日 Provider / タイプ 改定 1.1 2019年12月25日 Group / カテゴリ / Item 改定 1.2 2020年10月7日 Group / カテゴリ / Item 改定 1.3 2024年3月20日 Group / Database references / Refinement descriptionカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / em_3d_fitting_list / pdbx_initial_refinement_model Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _em_3d_fitting_list.accession_code / _em_3d_fitting_list.initial_refinement_model_id / _em_3d_fitting_list.source_name / _em_3d_fitting_list.type
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード MEMBRANE PROTEIN (膜タンパク質) /
MEMBRANE PROTEIN (膜タンパク質) /  KATP (ATP感受性カリウムチャネル) /
KATP (ATP感受性カリウムチャネル) /  SUR1 / RPG
SUR1 / RPG 機能・相同性情報
機能・相同性情報 ATP感受性カリウムチャネル / ABC-family proteins mediated transport / response to resveratrol / ventricular cardiac muscle tissue development / ATP-activated inward rectifier potassium channel activity / cell body fiber / inward rectifying potassium channel /
ATP感受性カリウムチャネル / ABC-family proteins mediated transport / response to resveratrol / ventricular cardiac muscle tissue development / ATP-activated inward rectifier potassium channel activity / cell body fiber / inward rectifying potassium channel /  sulfonylurea receptor activity / CAMKK-AMPK signaling cascade ...Regulation of insulin secretion /
sulfonylurea receptor activity / CAMKK-AMPK signaling cascade ...Regulation of insulin secretion /  ATP感受性カリウムチャネル / ABC-family proteins mediated transport / response to resveratrol / ventricular cardiac muscle tissue development / ATP-activated inward rectifier potassium channel activity / cell body fiber / inward rectifying potassium channel /
ATP感受性カリウムチャネル / ABC-family proteins mediated transport / response to resveratrol / ventricular cardiac muscle tissue development / ATP-activated inward rectifier potassium channel activity / cell body fiber / inward rectifying potassium channel /  sulfonylurea receptor activity / CAMKK-AMPK signaling cascade / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential /
sulfonylurea receptor activity / CAMKK-AMPK signaling cascade / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential /  inward rectifier potassium channel activity / ATPase-coupled monoatomic cation transmembrane transporter activity /
inward rectifier potassium channel activity / ATPase-coupled monoatomic cation transmembrane transporter activity /  nervous system process / regulation of monoatomic ion transmembrane transport / inorganic cation transmembrane transport /
nervous system process / regulation of monoatomic ion transmembrane transport / inorganic cation transmembrane transport /  活動電位 /
活動電位 /  ankyrin binding / Ion homeostasis / response to ATP / response to testosterone / potassium ion import across plasma membrane /
ankyrin binding / Ion homeostasis / response to ATP / response to testosterone / potassium ion import across plasma membrane /  voltage-gated potassium channel activity /
voltage-gated potassium channel activity /  potassium channel activity / regulation of insulin secretion /
potassium channel activity / regulation of insulin secretion /  axolemma /
axolemma /  介在板 / negative regulation of insulin secretion / ABC-type transporter activity / potassium ion transmembrane transport /
介在板 / negative regulation of insulin secretion / ABC-type transporter activity / potassium ion transmembrane transport /  横行小管 /
横行小管 /  heat shock protein binding /
heat shock protein binding /  regulation of membrane potential / acrosomal vesicle / response to ischemia / determination of adult lifespan / cellular response to glucose stimulus / positive regulation of protein localization to plasma membrane /
regulation of membrane potential / acrosomal vesicle / response to ischemia / determination of adult lifespan / cellular response to glucose stimulus / positive regulation of protein localization to plasma membrane /  筋鞘 / potassium ion transport / cellular response to nicotine / glucose metabolic process / response to estradiol /
筋鞘 / potassium ion transport / cellular response to nicotine / glucose metabolic process / response to estradiol /  presynaptic membrane /
presynaptic membrane /  核膜 / cellular response to tumor necrosis factor / transmembrane transporter binding / response to hypoxia /
核膜 / cellular response to tumor necrosis factor / transmembrane transporter binding / response to hypoxia /  エンドソーム / response to xenobiotic stimulus / neuronal cell body / glutamatergic synapse / apoptotic process /
エンドソーム / response to xenobiotic stimulus / neuronal cell body / glutamatergic synapse / apoptotic process /  ATP hydrolysis activity /
ATP hydrolysis activity /  ATP binding /
ATP binding /  細胞膜
細胞膜
 Cricetus cricetus (クロハラハムスクー)
Cricetus cricetus (クロハラハムスクー)
 Rattus norvegicus (ドブネズミ)
Rattus norvegicus (ドブネズミ) 電子顕微鏡法 /
電子顕微鏡法 /  単粒子再構成法 /
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.65 Å
クライオ電子顕微鏡法 / 解像度: 3.65 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Elife / 年: 2019
ジャーナル: Elife / 年: 2019
 構造の表示
構造の表示 ムービービューア
ムービービューア Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6pz9.cif.gz
6pz9.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6pz9.ent.gz
pdb6pz9.ent.gz PDB形式
PDB形式 6pz9.json.gz
6pz9.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/pz/6pz9
https://data.pdbj.org/pub/pdb/validation_reports/pz/6pz9 ftp://data.pdbj.org/pub/pdb/validation_reports/pz/6pz9
ftp://data.pdbj.org/pub/pdb/validation_reports/pz/6pz9 リンク
リンク 集合体
集合体
 要素
要素
 Cricetus cricetus (クロハラハムスクー)
Cricetus cricetus (クロハラハムスクー)
 Rattus norvegicus (ドブネズミ) / 参照: UniProt: Q09427
Rattus norvegicus (ドブネズミ) / 参照: UniProt: Q09427
 Rattus norvegicus (ドブネズミ) / 遺伝子: Kcnj11 / 細胞株 (発現宿主): INS - 1 cells clone 832/13 / 発現宿主:
Rattus norvegicus (ドブネズミ) / 遺伝子: Kcnj11 / 細胞株 (発現宿主): INS - 1 cells clone 832/13 / 発現宿主: 
 Rattus norvegicus (ドブネズミ) / 参照: UniProt: P70673
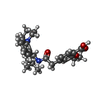
Rattus norvegicus (ドブネズミ) / 参照: UniProt: P70673 レパグリニド
レパグリニド アデノシン三リン酸
アデノシン三リン酸 電子顕微鏡法
電子顕微鏡法 単粒子再構成法
単粒子再構成法 試料調製
試料調製 : NO / 凍結
: NO / 凍結 : YES
: YES
 電子顕微鏡撮影
電子顕微鏡撮影
 :
:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM
FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM Bright-field microscopy
Bright-field microscopy 解析
解析
 : C1 (非対称)
: C1 (非対称)
 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj