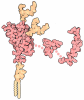
登録情報 データベース : PDB / ID : 6gl7タイトル Neurturin-GFRa2-RET extracellular complex GDNF family receptor alpha-2 Neurturin Proto-oncogene tyrosine-protein kinase receptor Ret キーワード / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 6.3 Å データ登録者 Bigalke, J.M. / Aibara, S. / Sandmark, J. / Amunts, A. 資金援助 組織 認可番号 国 FFL15:0325 Knut and Alice Wallenberg Foundation M44/16 Swedish Research Council NT_2015-04107 CAN 2017/1041
ジャーナル : Sci Adv / 年 : 2019タイトル : Cryo-EM structure of the activated RET signaling complex reveals the importance of its cysteine-rich domain.著者 : Janna M Bigalke / Shintaro Aibara / Robert Roth / Göran Dahl / Euan Gordon / Sarah Dorbéus / A Amunts / Jenny Sandmark / 要旨 : Signaling through the receptor tyrosine kinase RET is essential during normal development. Both gain- and loss-of-function mutations are involved in a variety of diseases, yet the molecular details ... Signaling through the receptor tyrosine kinase RET is essential during normal development. Both gain- and loss-of-function mutations are involved in a variety of diseases, yet the molecular details of receptor activation have remained elusive. We have reconstituted the complete extracellular region of the RET signaling complex together with Neurturin (NRTN) and GFRα2 and determined its structure at 5.7-Å resolution by cryo-EM. The proteins form an assembly through RET-GFRα2 and RET-NRTN interfaces. Two key interaction points required for RET extracellular domain binding were observed: (i) the calcium-binding site in RET that contacts GFRα2 domain 3 and (ii) the RET cysteine-rich domain interaction with NRTN. The structure highlights the importance of the RET cysteine-rich domain and allows proposition of a model to explain how complex formation leads to RET receptor dimerization and its activation. This provides a framework for targeting RET activity and for further exploration of mechanisms underlying neurological diseases. 履歴 登録 2018年5月23日 登録サイト / 処理サイト 改定 1.0 2019年8月14日 Provider / タイプ 改定 1.1 2019年8月21日 Group / Database references / カテゴリ / citation_authorItem _citation.journal_volume / _citation.page_first ... _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_PubMed / _citation.title / _citation_author.identifier_ORCID 改定 1.2 2019年12月18日 Group / カテゴリ Item / _atom_sites.fract_transf_matrix[2][2] / _atom_sites.fract_transf_matrix[3][3]
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード SIGNALING PROTEIN / Neurotrophic signalling /
SIGNALING PROTEIN / Neurotrophic signalling /  Receptor tyrosine kinase (受容体型チロシンキナーゼ) / GDNF family of ligands
Receptor tyrosine kinase (受容体型チロシンキナーゼ) / GDNF family of ligands 機能・相同性情報
機能・相同性情報 membrane protein proteolysis ...glial cell-derived neurotrophic factor receptor activity / glial cell-derived neurotrophic factor receptor binding / glial cell-derived neurotrophic factor receptor signaling pathway / Peyer's patch morphogenesis / positive regulation of metanephric glomerulus development / posterior midgut development / ureter maturation / embryonic epithelial tube formation / lymphocyte migration into lymphoid organs /
membrane protein proteolysis ...glial cell-derived neurotrophic factor receptor activity / glial cell-derived neurotrophic factor receptor binding / glial cell-derived neurotrophic factor receptor signaling pathway / Peyer's patch morphogenesis / positive regulation of metanephric glomerulus development / posterior midgut development / ureter maturation / embryonic epithelial tube formation / lymphocyte migration into lymphoid organs /  membrane protein proteolysis / positive regulation of peptidyl-serine phosphorylation of STAT protein / positive regulation of neuron maturation / neuron cell-cell adhesion /
membrane protein proteolysis / positive regulation of peptidyl-serine phosphorylation of STAT protein / positive regulation of neuron maturation / neuron cell-cell adhesion /  enteric nervous system development / nerve development /
enteric nervous system development / nerve development /  神経 /
神経 /  plasma membrane protein complex / neuron maturation / NCAM1 interactions / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / positive regulation of cell adhesion mediated by integrin /
plasma membrane protein complex / neuron maturation / NCAM1 interactions / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / positive regulation of cell adhesion mediated by integrin /  神経堤 / ureteric bud development / response to pain /
神経堤 / ureteric bud development / response to pain /  extrinsic component of membrane /
extrinsic component of membrane /  regulation of axonogenesis / homophilic cell adhesion via plasma membrane adhesion molecules / positive regulation of cell size / RET signaling /
regulation of axonogenesis / homophilic cell adhesion via plasma membrane adhesion molecules / positive regulation of cell size / RET signaling /  regulation of cell adhesion / cellular response to retinoic acid / NPAS4 regulates expression of target genes /
regulation of cell adhesion / cellular response to retinoic acid / NPAS4 regulates expression of target genes /  transmembrane receptor protein tyrosine kinase activity /
transmembrane receptor protein tyrosine kinase activity /  軸索誘導 /
軸索誘導 /  growth factor activity / positive regulation of neuron projection development /
growth factor activity / positive regulation of neuron projection development /  receptor tyrosine kinase binding /
receptor tyrosine kinase binding /  受容体型チロシンキナーゼ / neuron projection development /
受容体型チロシンキナーゼ / neuron projection development /  cell surface receptor protein tyrosine kinase signaling pathway / activation of cysteine-type endopeptidase activity involved in apoptotic process /
cell surface receptor protein tyrosine kinase signaling pathway / activation of cysteine-type endopeptidase activity involved in apoptotic process /  分裂促進因子活性化タンパク質キナーゼ / retina development in camera-type eye /
分裂促進因子活性化タンパク質キナーゼ / retina development in camera-type eye /  signaling receptor activity /
signaling receptor activity /  nervous system development / RAF/MAP kinase cascade /
nervous system development / RAF/MAP kinase cascade /  protein tyrosine kinase activity / positive regulation of MAPK cascade / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction /
protein tyrosine kinase activity / positive regulation of MAPK cascade / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction /  エンドソーム /
エンドソーム /  receptor complex / endosome membrane / positive regulation of cell migration / response to xenobiotic stimulus /
receptor complex / endosome membrane / positive regulation of cell migration / response to xenobiotic stimulus /  神経繊維 / external side of plasma membrane /
神経繊維 / external side of plasma membrane /  signaling receptor binding /
signaling receptor binding /  protein phosphorylation /
protein phosphorylation /  樹状突起 / neuronal cell body /
樹状突起 / neuronal cell body /  calcium ion binding / positive regulation of gene expression / positive regulation of DNA-templated transcription /
calcium ion binding / positive regulation of gene expression / positive regulation of DNA-templated transcription /  シグナル伝達 / extracellular region /
シグナル伝達 / extracellular region /  ATP binding /
ATP binding /  細胞膜
細胞膜
 Homo sapiens (ヒト)
Homo sapiens (ヒト) 電子顕微鏡法 /
電子顕微鏡法 /  単粒子再構成法 /
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 6.3 Å
クライオ電子顕微鏡法 / 解像度: 6.3 Å  データ登録者
データ登録者 スウェーデン, 5件
スウェーデン, 5件  引用
引用 ジャーナル: Sci Adv / 年: 2019
ジャーナル: Sci Adv / 年: 2019
 構造の表示
構造の表示 ムービービューア
ムービービューア Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6gl7.cif.gz
6gl7.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6gl7.ent.gz
pdb6gl7.ent.gz PDB形式
PDB形式 6gl7.json.gz
6gl7.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/gl/6gl7
https://data.pdbj.org/pub/pdb/validation_reports/gl/6gl7 ftp://data.pdbj.org/pub/pdb/validation_reports/gl/6gl7
ftp://data.pdbj.org/pub/pdb/validation_reports/gl/6gl7 リンク
リンク 集合体
集合体
 要素
要素

 Homo sapiens (ヒト) / 遺伝子: NRTN / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: NRTN / 発現宿主: 
 Escherichia coli (大腸菌) / 参照: UniProt: Q99748
Escherichia coli (大腸菌) / 参照: UniProt: Q99748 GFRα / GFR-alpha-2 / GDNF receptor beta / GDNFR-beta / Neurturin receptor alpha / NTNR-alpha / RET ligand ...GFR-alpha-2 / GDNF receptor beta / GDNFR-beta / Neurturin receptor alpha / NTNR-alpha / RET ligand 2 / TGF-beta-related neurotrophic factor receptor 2
GFRα / GFR-alpha-2 / GDNF receptor beta / GDNFR-beta / Neurturin receptor alpha / NTNR-alpha / RET ligand ...GFR-alpha-2 / GDNF receptor beta / GDNFR-beta / Neurturin receptor alpha / NTNR-alpha / RET ligand 2 / TGF-beta-related neurotrophic factor receptor 2
 Homo sapiens (ヒト) / 遺伝子: GFRA2, GDNFRB, RETL2, TRNR2
Homo sapiens (ヒト) / 遺伝子: GFRA2, GDNFRB, RETL2, TRNR2
 Cricetulus griseus (モンゴルキヌゲネズミ)
Cricetulus griseus (モンゴルキヌゲネズミ)
 Homo sapiens (ヒト) / 遺伝子: RET, CDHF12, CDHR16, PTC, RET51
Homo sapiens (ヒト) / 遺伝子: RET, CDHF12, CDHR16, PTC, RET51
 Cricetulus griseus (モンゴルキヌゲネズミ)
Cricetulus griseus (モンゴルキヌゲネズミ) 受容体型チロシンキナーゼ
受容体型チロシンキナーゼ 電子顕微鏡法
電子顕微鏡法 単粒子再構成法
単粒子再構成法 試料調製
試料調製 : NO / 凍結
: NO / 凍結 : YES
: YES
 電子顕微鏡撮影
電子顕微鏡撮影
 :
:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM
FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM Bright-field microscopy
Bright-field microscopy 解析
解析
 : C2 (2回回転対称
: C2 (2回回転対称 )
)
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj