| 登録情報 | データベース: PDB / ID: 4wh4
|
|---|
| タイトル | Protein GB1 Quadruple Mutant I6H/N8H/K28H/Q32H |
|---|
 要素 要素 | Immunoglobulin G-binding protein G |
|---|
 キーワード キーワード |  SIGNALING PROTEIN / Immunoglobulin-Binding Domain SIGNALING PROTEIN / Immunoglobulin-Binding Domain |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
IgG-binding B / B domain / M protein-type anchor domain / GA-like domain / GA-like domain / Ubiquitin-like (UB roll) - #10 / Immunoglobulin/albumin-binding domain superfamily / YSIRK Gram-positive signal peptide / LPXTG cell wall anchor motif / Gram-positive cocci surface proteins LPxTG motif profile. ...IgG-binding B / B domain / M protein-type anchor domain / GA-like domain / GA-like domain / Ubiquitin-like (UB roll) - #10 / Immunoglobulin/albumin-binding domain superfamily / YSIRK Gram-positive signal peptide / LPXTG cell wall anchor motif / Gram-positive cocci surface proteins LPxTG motif profile. / LPXTG cell wall anchor domain / Ubiquitin-like (UB roll) / Roll / Alpha Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Streptococcus sp. group G (バクテリア) Streptococcus sp. group G (バクテリア) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.2 Å 分子置換 / 解像度: 2.2 Å |
|---|
 データ登録者 データ登録者 | Cunningham, T.C. / Horne, W.S. / Saxena, S. |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Science Foundation (NSF, United States) | MCB 1157712 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2015 ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2015
タイトル: The double-histidine Cu2+-binding motif: a highly rigid, site-specific spin probe for electron spin resonance distance measurements.
著者: Cunningham, T.F. / Putterman, M.R. / Desai, A. / Horne, W.S. / Saxena, S. |
|---|
| 履歴 | | 登録 | 2014年9月19日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2015年8月5日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2017年9月6日 | Group: Author supporting evidence / Database references / Derived calculations
カテゴリ: citation / pdbx_audit_support / pdbx_struct_oper_list
Item: _citation.journal_id_CSD / _pdbx_audit_support.funding_organization / _pdbx_struct_oper_list.symmetry_operation |
|---|
| 改定 1.2 | 2019年11月27日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.3 | 2023年9月27日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード SIGNALING PROTEIN / Immunoglobulin-Binding Domain
SIGNALING PROTEIN / Immunoglobulin-Binding Domain 機能・相同性情報
機能・相同性情報 Streptococcus sp. group G (バクテリア)
Streptococcus sp. group G (バクテリア) X線回折 /
X線回折 /  分子置換 / 解像度: 2.2 Å
分子置換 / 解像度: 2.2 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2015
ジャーナル: Angew.Chem.Int.Ed.Engl. / 年: 2015 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4wh4.cif.gz
4wh4.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4wh4.ent.gz
pdb4wh4.ent.gz PDB形式
PDB形式 4wh4.json.gz
4wh4.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/wh/4wh4
https://data.pdbj.org/pub/pdb/validation_reports/wh/4wh4 ftp://data.pdbj.org/pub/pdb/validation_reports/wh/4wh4
ftp://data.pdbj.org/pub/pdb/validation_reports/wh/4wh4
 リンク
リンク 集合体
集合体
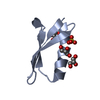
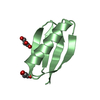
 要素
要素 Streptococcus sp. group G (バクテリア)
Streptococcus sp. group G (バクテリア)
 Escherichia coli (大腸菌) / 参照: UniProt: P19909
Escherichia coli (大腸菌) / 参照: UniProt: P19909 硫酸塩
硫酸塩 グリセリン
グリセリン 水
水 X線回折
X線回折 試料調製
試料調製
 回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.5418 Å
回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.5418 Å : 1.5418 Å / 相対比: 1
: 1.5418 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー




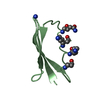








 PDBj
PDBj






