| 登録情報 | データベース: PDB / ID: 4np9
|
|---|
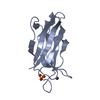
| タイトル | Structure of Rabphilin C2A domain bound to IP3 |
|---|
 要素 要素 | Rabphilin-3A |
|---|
 キーワード キーワード |  PROTEIN TRANSPORT / RABPHILIN-3A / PROTEIN TRANSPORT / RABPHILIN-3A /  C2 DOMAIN (C2ドメイン) / C2A / C2 DOMAIN (C2ドメイン) / C2A /  CALCIUM BINDING (カルシウム) / SYNAPTIC EXOCYTOSIS METAL-BINDING / C-2 domain fold / EXOPHILIN-1 CALCIUM BINDING (カルシウム) / SYNAPTIC EXOCYTOSIS METAL-BINDING / C-2 domain fold / EXOPHILIN-1 |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
 selenium binding / spontaneous neurotransmitter secretion / selenium binding / spontaneous neurotransmitter secretion /  extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse / extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse /  inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming / inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming /  extrinsic component of membrane ... extrinsic component of membrane ... selenium binding / spontaneous neurotransmitter secretion / selenium binding / spontaneous neurotransmitter secretion /  extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse / extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse /  inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming / inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming /  extrinsic component of membrane / extrinsic component of membrane /  phosphate ion binding / phosphate ion binding /  エキソサイトーシス / エキソサイトーシス /  regulation of NMDA receptor activity / regulation of NMDA receptor activity /  phosphatidylinositol-4,5-bisphosphate binding / phosphatidylinositol-4,5-bisphosphate binding /  分泌 / 分泌 /  phospholipid binding / phospholipid binding /  intracellular protein transport / intracellular protein transport /  neuromuscular junction / synaptic vesicle membrane / neuromuscular junction / synaptic vesicle membrane /  small GTPase binding / small GTPase binding /  シナプス小胞 / シナプス小胞 /  postsynaptic membrane / postsynaptic membrane /  樹状突起スパイン / neuron projection / 樹状突起スパイン / neuron projection /  シナプス / シナプス /  calcium ion binding / protein-containing complex binding / protein-containing complex / zinc ion binding類似検索 - 分子機能 calcium ion binding / protein-containing complex binding / protein-containing complex / zinc ion binding類似検索 - 分子機能Rabphilin-3A / : / Rabphilin/DOC2/Noc2 / Rab-binding domain / FYVE-type zinc finger / FYVE-type zinc finger / Rab-binding domain profile. /  Zinc finger, FYVE-related / Zinc finger FYVE/FYVE-related type profile. / Zinc finger, FYVE-related / Zinc finger FYVE/FYVE-related type profile. /  Synaptotagmin ...Rabphilin-3A / : / Rabphilin/DOC2/Noc2 / Rab-binding domain / FYVE-type zinc finger / FYVE-type zinc finger / Rab-binding domain profile. / Synaptotagmin ...Rabphilin-3A / : / Rabphilin/DOC2/Noc2 / Rab-binding domain / FYVE-type zinc finger / FYVE-type zinc finger / Rab-binding domain profile. /  Zinc finger, FYVE-related / Zinc finger FYVE/FYVE-related type profile. / Zinc finger, FYVE-related / Zinc finger FYVE/FYVE-related type profile. /  Synaptotagmin / Synaptotagmin /  C2ドメイン / C2ドメイン /  C2ドメイン / Protein kinase C conserved region 2 (CalB) / C2ドメイン / Protein kinase C conserved region 2 (CalB) /  C2ドメイン / C2 domain profile. / C2 domain superfamily / C2ドメイン / C2 domain profile. / C2 domain superfamily /  Zinc finger, FYVE/PHD-type / Zinc finger, FYVE/PHD-type /  Zinc finger, RING/FYVE/PHD-type / Zinc finger, RING/FYVE/PHD-type /  Immunoglobulin-like / Immunoglobulin-like /  サンドイッチ / Mainly Beta類似検索 - ドメイン・相同性 サンドイッチ / Mainly Beta類似検索 - ドメイン・相同性 D-MYO-INOSITOL-1,4,5-TRIPHOSPHATE / Rabphilin-3A類似検索 - 構成要素 |
|---|
| 生物種 |    Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.92 Å 分子置換 / 解像度: 1.92 Å |
|---|
 データ登録者 データ登録者 | Guillen, J. / Ferrer-Orta, C. / Buxaderas, M. / Perez-Sanchez, D. / Guerrero-Valero, M. / Luengo-Gil, G. / Pous, J. / Guerra, P. / Gomez-Fernandez, J.C. / Verdaguer, N. / Corbalan-Garcia, S. |
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013
タイトル: Structural insights into the Ca2+ and PI(4,5)P2 binding modes of the C2 domains of rabphilin 3A and synaptotagmin 1.
著者: Guillen, J. / Ferrer-Orta, C. / Buxaderas, M. / Perez-Sanchez, D. / Guerrero-Valero, M. / Luengo-Gil, G. / Pous, J. / Guerra, P. / Gomez-Fernandez, J.C. / Verdaguer, N. / Corbalan-Garcia, S. |
|---|
| 履歴 | | 登録 | 2013年11月21日 | 登録サイト: RCSB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2013年12月25日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2022年8月24日 | Group: Database references / Derived calculations / カテゴリ: citation / database_2 / struct_site
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード PROTEIN TRANSPORT / RABPHILIN-3A /
PROTEIN TRANSPORT / RABPHILIN-3A /  C2 DOMAIN (C2ドメイン) / C2A /
C2 DOMAIN (C2ドメイン) / C2A /  CALCIUM BINDING (カルシウム) / SYNAPTIC EXOCYTOSIS METAL-BINDING / C-2 domain fold / EXOPHILIN-1
CALCIUM BINDING (カルシウム) / SYNAPTIC EXOCYTOSIS METAL-BINDING / C-2 domain fold / EXOPHILIN-1 機能・相同性情報
機能・相同性情報 selenium binding / spontaneous neurotransmitter secretion /
selenium binding / spontaneous neurotransmitter secretion /  extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse /
extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse /  inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming /
inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming /  extrinsic component of membrane ...
extrinsic component of membrane ... selenium binding / spontaneous neurotransmitter secretion /
selenium binding / spontaneous neurotransmitter secretion /  extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse /
extrinsic component of synaptic vesicle membrane / regulation of calcium ion-dependent exocytosis / cholinergic synapse /  inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming /
inositol 1,4,5 trisphosphate binding / calcium-dependent phospholipid binding / dendritic spine organization / synaptic vesicle priming /  extrinsic component of membrane /
extrinsic component of membrane /  phosphate ion binding /
phosphate ion binding /  エキソサイトーシス /
エキソサイトーシス /  regulation of NMDA receptor activity /
regulation of NMDA receptor activity /  phosphatidylinositol-4,5-bisphosphate binding /
phosphatidylinositol-4,5-bisphosphate binding /  分泌 /
分泌 /  phospholipid binding /
phospholipid binding /  intracellular protein transport /
intracellular protein transport /  neuromuscular junction / synaptic vesicle membrane /
neuromuscular junction / synaptic vesicle membrane /  small GTPase binding /
small GTPase binding /  シナプス小胞 /
シナプス小胞 /  postsynaptic membrane /
postsynaptic membrane /  樹状突起スパイン / neuron projection /
樹状突起スパイン / neuron projection /  シナプス /
シナプス /  calcium ion binding / protein-containing complex binding / protein-containing complex / zinc ion binding
calcium ion binding / protein-containing complex binding / protein-containing complex / zinc ion binding
 Rattus norvegicus (ドブネズミ)
Rattus norvegicus (ドブネズミ) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.92 Å
分子置換 / 解像度: 1.92 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4np9.cif.gz
4np9.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4np9.ent.gz
pdb4np9.ent.gz PDB形式
PDB形式 4np9.json.gz
4np9.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/np/4np9
https://data.pdbj.org/pub/pdb/validation_reports/np/4np9 ftp://data.pdbj.org/pub/pdb/validation_reports/np/4np9
ftp://data.pdbj.org/pub/pdb/validation_reports/np/4np9 リンク
リンク 集合体
集合体
 要素
要素
 Rattus norvegicus (ドブネズミ) / 遺伝子: Rph3a / プラスミド: pET28a / 発現宿主:
Rattus norvegicus (ドブネズミ) / 遺伝子: Rph3a / プラスミド: pET28a / 発現宿主: 
 Escherichia coli (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: P47709
Escherichia coli (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: P47709 イノシトールトリスリン酸
イノシトールトリスリン酸 硫酸塩
硫酸塩 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  SOLEIL
SOLEIL  / ビームライン: PROXIMA 1 / 波長: 0.98011 Å
/ ビームライン: PROXIMA 1 / 波長: 0.98011 Å : 0.98011 Å / 相対比: 1
: 0.98011 Å / 相対比: 1  解析
解析 :
:  分子置換 / 解像度: 1.92→29.566 Å / SU ML: 0.26 / σ(F): 0.02 / 位相誤差: 25.27 / 立体化学のターゲット値: ML
分子置換 / 解像度: 1.92→29.566 Å / SU ML: 0.26 / σ(F): 0.02 / 位相誤差: 25.27 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj