+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4frd | ||||||
|---|---|---|---|---|---|---|---|
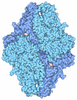
| タイトル | Crystal Structure of ABBA+UDP+Gal at pH 9.0 with MPD as the cryoprotectant | ||||||
 要素 要素 | Histo-blood group ABO system transferase | ||||||
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  MANGANESE (マンガン) / ABO ROSSMANN FOLD / RETAINING GLYCOSYLTRANSFERASE / MANGANESE (マンガン) / ABO ROSSMANN FOLD / RETAINING GLYCOSYLTRANSFERASE /  GLYCOPROTEIN (糖タンパク質) / GLYCOPROTEIN (糖タンパク質) /  BLOOD GROUP ANTIGEN (血液型) / METAL-BINDING BLOOD GROUP ANTIGEN (血液型) / METAL-BINDING | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 フコシルガラクトシド 3-α-ガラクトシルトランスフェラーゼ / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase activity / フコシルガラクトシド 3-α-ガラクトシルトランスフェラーゼ / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase activity /  fucosylgalactoside 3-alpha-galactosyltransferase activity / ABO blood group biosynthesis / fucosylgalactoside 3-alpha-galactosyltransferase activity / ABO blood group biosynthesis /  hexosyltransferase activity / lipid glycosylation / Golgi cisterna membrane / protein glycosylation / hexosyltransferase activity / lipid glycosylation / Golgi cisterna membrane / protein glycosylation /  antigen binding ... antigen binding ... フコシルガラクトシド 3-α-ガラクトシルトランスフェラーゼ / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase activity / フコシルガラクトシド 3-α-ガラクトシルトランスフェラーゼ / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase activity /  fucosylgalactoside 3-alpha-galactosyltransferase activity / ABO blood group biosynthesis / fucosylgalactoside 3-alpha-galactosyltransferase activity / ABO blood group biosynthesis /  hexosyltransferase activity / lipid glycosylation / Golgi cisterna membrane / protein glycosylation / hexosyltransferase activity / lipid glycosylation / Golgi cisterna membrane / protein glycosylation /  antigen binding / manganese ion binding / vesicle / carbohydrate metabolic process / antigen binding / manganese ion binding / vesicle / carbohydrate metabolic process /  ゴルジ体 / ゴルジ体 /  nucleotide binding / nucleotide binding /  ゴルジ体 / extracellular region / ゴルジ体 / extracellular region /  生体膜 / 生体膜 /  metal ion binding metal ion binding類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.55 Å 分子置換 / 解像度: 1.55 Å | ||||||
 データ登録者 データ登録者 | Johal, A.R. / Alfaro, J.A. / Blackler, R.J. / Schuman, B. / Borisova, S.N. / Evans, S.V. | ||||||
 引用 引用 |  ジャーナル: Glycobiology / 年: 2014 ジャーナル: Glycobiology / 年: 2014タイトル: pH-induced conformational changes in human ABO(H) blood group glycosyltransferases confirm the importance of electrostatic interactions in the formation of the semi-closed state. 著者: Johal, A.R. / Blackler, R.J. / Alfaro, J.A. / Schuman, B. / Borisova, S. / Evans, S.V. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4frd.cif.gz 4frd.cif.gz | 135.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4frd.ent.gz pdb4frd.ent.gz | 104.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4frd.json.gz 4frd.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fr/4frd https://data.pdbj.org/pub/pdb/validation_reports/fr/4frd ftp://data.pdbj.org/pub/pdb/validation_reports/fr/4frd ftp://data.pdbj.org/pub/pdb/validation_reports/fr/4frd | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  4fqwC  4fraC  4frbC  4freC  4frhC  4frlC  4frmC  4froC  4frpC  4frqC  4gbpC  4kxoC  1lz7S C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 34371.672 Da / 分子数: 1 / 断片: GTB / 変異: G176R, A268G / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: ABO / プラスミド: PCW DELTA 1AC / 発現宿主: Homo sapiens (ヒト) / 遺伝子: ABO / プラスミド: PCW DELTA 1AC / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): BL21 GOLD Escherichia coli (大腸菌) / 株 (発現宿主): BL21 GOLD参照: UniProt: H6A2X0, UniProt: P16442*PLUS, glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase,  フコシルガラクトシド 3-α-ガラクトシルトランスフェラーゼ フコシルガラクトシド 3-α-ガラクトシルトランスフェラーゼ |
|---|---|
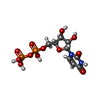
| #2: 化合物 | ChemComp-UDP /  ウリジン二リン酸 ウリジン二リン酸 |
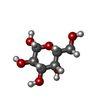
| #3: 糖 | ChemComp-GAL /  ガラクトース ガラクトース |
| #4: 化合物 | ChemComp-MN / |
| #5: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.27 Å3/Da / 溶媒含有率: 45.91 % |
|---|---|
結晶化 | 温度: 298 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 8 詳細: 1% PEG 4000, 5% MPD, 5 mM manganese chloride, 100 mM ammonium sulfate, 70 mM sodium chloride, 50 mM ADA, 30 mM sodium acetate with 20% MPD as cryoprotectant, pH 8.0, VAPOR DIFFUSION, HANGING ...詳細: 1% PEG 4000, 5% MPD, 5 mM manganese chloride, 100 mM ammonium sulfate, 70 mM sodium chloride, 50 mM ADA, 30 mM sodium acetate with 20% MPD as cryoprotectant, pH 8.0, VAPOR DIFFUSION, HANGING DROP, temperature 298K |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU MICROMAX-002 / 波長: 1.54 Å 回転陽極 / タイプ: RIGAKU MICROMAX-002 / 波長: 1.54 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: RIGAKU RAXIS / 検出器: IMAGE PLATE / 日付: 2008年12月4日 / 詳細: OSMIC BLUE MIRRORS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 1.54 Å / 相対比: 1 : 1.54 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.55→20 Å / Num. obs: 44858 / % possible obs: 97.8 % / 冗長度: 4.43 % / Rmerge(I) obs: 0.036 / Χ2: 0.94 / Net I/σ(I): 17.5 / Scaling rejects: 1502 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
-位相決定
位相決定 | 手法:  分子置換 分子置換 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR | Rfactor: 28.99 / Model details: Phaser MODE: MR_AUTO
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 1LZ7 解像度: 1.55→20 Å / Cor.coef. Fo:Fc: 0.971 / Cor.coef. Fo:Fc free: 0.958 / Occupancy max: 1 / Occupancy min: 0 / SU B: 1.371 / SU ML: 0.05 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.082 / ESU R Free: 0.085 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : REFINED INDIVIDUALLY
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 102.85 Å2 / Biso mean: 25.1813 Å2 / Biso min: 10.75 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.55→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.55→1.59 Å / Total num. of bins used: 20
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj