+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4cxh | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Regulation of the mammalian elongation cycle by 40S subunit rolling: a eukaryotic-specific ribosome rearrangement | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード |  TRANSLATION (翻訳 (生物学)) / MAMMALIAN 80S RIBOSOME / ELONGATION CYCLE / TRNA SELECTION / EUKARYOTIC TERNARY COMPLEX / ELONGATION FACTOR EEF1A TRANSLATION (翻訳 (生物学)) / MAMMALIAN 80S RIBOSOME / ELONGATION CYCLE / TRNA SELECTION / EUKARYOTIC TERNARY COMPLEX / ELONGATION FACTOR EEF1A | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Formation of the ternary complex, and subsequently, the 43S complex / Ribosomal scanning and start codon recognition / Translation initiation complex formation / SARS-CoV-1 modulates host translation machinery /  ヒドロキシル化 / Peptide chain elongation / Selenocysteine synthesis / Formation of a pool of free 40S subunits / Eukaryotic Translation Termination / Response of EIF2AK4 (GCN2) to amino acid deficiency ...Formation of the ternary complex, and subsequently, the 43S complex / Ribosomal scanning and start codon recognition / Translation initiation complex formation / SARS-CoV-1 modulates host translation machinery / ヒドロキシル化 / Peptide chain elongation / Selenocysteine synthesis / Formation of a pool of free 40S subunits / Eukaryotic Translation Termination / Response of EIF2AK4 (GCN2) to amino acid deficiency ...Formation of the ternary complex, and subsequently, the 43S complex / Ribosomal scanning and start codon recognition / Translation initiation complex formation / SARS-CoV-1 modulates host translation machinery /  ヒドロキシル化 / Peptide chain elongation / Selenocysteine synthesis / Formation of a pool of free 40S subunits / Eukaryotic Translation Termination / Response of EIF2AK4 (GCN2) to amino acid deficiency / SRP-dependent cotranslational protein targeting to membrane / Viral mRNA Translation / Nonsense Mediated Decay (NMD) independent of the Exon Junction Complex (EJC) / GTP hydrolysis and joining of the 60S ribosomal subunit / L13a-mediated translational silencing of Ceruloplasmin expression / Major pathway of rRNA processing in the nucleolus and cytosol / ヒドロキシル化 / Peptide chain elongation / Selenocysteine synthesis / Formation of a pool of free 40S subunits / Eukaryotic Translation Termination / Response of EIF2AK4 (GCN2) to amino acid deficiency / SRP-dependent cotranslational protein targeting to membrane / Viral mRNA Translation / Nonsense Mediated Decay (NMD) independent of the Exon Junction Complex (EJC) / GTP hydrolysis and joining of the 60S ribosomal subunit / L13a-mediated translational silencing of Ceruloplasmin expression / Major pathway of rRNA processing in the nucleolus and cytosol /  小胞体 / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / 小胞体 / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) /  translation elongation factor activity / translation elongation factor activity /  stress granule assembly / small-subunit processome / cytosolic ribosome / maintenance of translational fidelity / stress granule assembly / small-subunit processome / cytosolic ribosome / maintenance of translational fidelity /  ribosomal small subunit biogenesis / Regulation of expression of SLITs and ROBOs / cytosolic small ribosomal subunit / cytoplasmic translation / SARS-CoV-2 modulates host translation machinery / ribosomal small subunit biogenesis / Regulation of expression of SLITs and ROBOs / cytosolic small ribosomal subunit / cytoplasmic translation / SARS-CoV-2 modulates host translation machinery /  リボソーム / structural constituent of ribosome / リボソーム / structural constituent of ribosome /  翻訳 (生物学) / 翻訳 (生物学) /  GTPase activity / GTPase activity /  シナプス / GTP binding / シナプス / GTP binding /  核小体 / 核小体 /  小胞体 / 小胞体 /  RNA binding / RNA binding /  核質 / 核質 /  生体膜 / 生体膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||
| 生物種 |   ESCHERICHIA COLI (大腸菌) ESCHERICHIA COLI (大腸菌)  ORYCTOLAGUS CUNICULUS (ウサギ) ORYCTOLAGUS CUNICULUS (ウサギ) | ||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 8.9 Å クライオ電子顕微鏡法 / 解像度: 8.9 Å | ||||||||||||
 データ登録者 データ登録者 | Budkevich, T.V. / Giesebrecht, J. / Behrmann, E. / Loerke, J. / Ramrath, D.J.F. / Mielke, T. / Ismer, J. / Hildebrand, P. / Tung, C.-S. / Nierhaus, K.H. ...Budkevich, T.V. / Giesebrecht, J. / Behrmann, E. / Loerke, J. / Ramrath, D.J.F. / Mielke, T. / Ismer, J. / Hildebrand, P. / Tung, C.-S. / Nierhaus, K.H. / Sanbonmatsu, K.Y. / Spahn, C.M.T. | ||||||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2014 ジャーナル: Cell / 年: 2014タイトル: Regulation of the mammalian elongation cycle by subunit rolling: a eukaryotic-specific ribosome rearrangement. 著者: Tatyana V Budkevich / Jan Giesebrecht / Elmar Behrmann / Justus Loerke / David J F Ramrath / Thorsten Mielke / Jochen Ismer / Peter W Hildebrand / Chang-Shung Tung / Knud H Nierhaus / Karissa ...著者: Tatyana V Budkevich / Jan Giesebrecht / Elmar Behrmann / Justus Loerke / David J F Ramrath / Thorsten Mielke / Jochen Ismer / Peter W Hildebrand / Chang-Shung Tung / Knud H Nierhaus / Karissa Y Sanbonmatsu / Christian M T Spahn /    要旨: The extent to which bacterial ribosomes and the significantly larger eukaryotic ribosomes share the same mechanisms of ribosomal elongation is unknown. Here, we present subnanometer resolution ...The extent to which bacterial ribosomes and the significantly larger eukaryotic ribosomes share the same mechanisms of ribosomal elongation is unknown. Here, we present subnanometer resolution cryoelectron microscopy maps of the mammalian 80S ribosome in the posttranslocational state and in complex with the eukaryotic eEF1A⋅Val-tRNA⋅GMPPNP ternary complex, revealing significant differences in the elongation mechanism between bacteria and mammals. Surprisingly, and in contrast to bacterial ribosomes, a rotation of the small subunit around its long axis and orthogonal to the well-known intersubunit rotation distinguishes the posttranslocational state from the classical pretranslocational state ribosome. We term this motion "subunit rolling." Correspondingly, a mammalian decoding complex visualized in substates before and after codon recognition reveals structural distinctions from the bacterial system. These findings suggest how codon recognition leads to GTPase activation in the mammalian system and demonstrate that in mammalia subunit rolling occurs during tRNA selection. | ||||||||||||
| 履歴 |
| ||||||||||||
| Remark 700 | SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS "XA" IN EACH CHAIN ON SHEET RECORDS BELOW ... SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS "XA" IN EACH CHAIN ON SHEET RECORDS BELOW IS ACTUALLY AN 5-STRANDED BARREL THIS IS REPRESENTED BY A 6-STRANDED SHEET IN WHICH THE FIRST AND LAST STRANDS ARE IDENTICAL. |
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4cxh.cif.gz 4cxh.cif.gz | 299.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4cxh.ent.gz pdb4cxh.ent.gz | 234.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4cxh.json.gz 4cxh.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cx/4cxh https://data.pdbj.org/pub/pdb/validation_reports/cx/4cxh ftp://data.pdbj.org/pub/pdb/validation_reports/cx/4cxh ftp://data.pdbj.org/pub/pdb/validation_reports/cx/4cxh | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-RNA鎖 , 7種, 7分子 12Yabcx
| #1: RNA鎖 | 分子量: 43635.969 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 36162 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 36162 |
|---|---|
| #2: RNA鎖 | 分子量: 15974.376 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 337381 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 337381 |
| #5: RNA鎖 |  転移RNA 転移RNA分子量: 24686.006 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: ORYCTOLAGUS CUNICULUS (ウサギ) / 参照:  GenBank: 4338 GenBank: 4338 |
| #6: RNA鎖 | 分子量: 15424.328 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 36162 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 36162 |
| #7: RNA鎖 | 分子量: 5445.253 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 36162 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 36162 |
| #8: RNA鎖 | 分子量: 6140.738 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 337381 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: GenBank: 337381 |
| #9: RNA鎖 |  伝令RNA 伝令RNA分子量: 8527.686 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   ESCHERICHIA COLI (大腸菌) ESCHERICHIA COLI (大腸菌)解説: FOR MODELING MRNA (CHAIN 1, PDB ID CODE 3I8G) WAS USED 発現宿主:   ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): K-12 ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): K-12 |
-タンパク質 , 2種, 2分子 AX
| #3: タンパク質 | 分子量: 48734.527 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: UniProt: Q9YAV0 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: UniProt: Q9YAV0 |
|---|---|
| #4: タンパク質 |  / 40S RIBOSOMAL PROTEIN S23 / 40S RIBOSOMAL PROTEIN S23分子量: 15844.666 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: UniProt: P62266 ORYCTOLAGUS CUNICULUS (ウサギ) / 参照: UniProt: P62266 |
-非ポリマー , 1種, 1分子 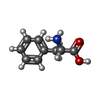
| #10: 化合物 | ChemComp-PHE /  フェニルアラニン フェニルアラニン |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: CODON RECOGNITION - GTPASE ACTIVATION STATE OF MAMMALIAN 80S RIBOSOME タイプ: RIBOSOME |
|---|---|
| 緩衝液 | 名称: 20 MM HEPES, 5 MM MGCL2, 100 MM NH4CL, 6 MM BETA- MERCAPTOETHANOL, 0.8 MM SPERMIDINE, 0.6 MM SPERMINE pH: 7.5 詳細: 20 MM HEPES, 5 MM MGCL2, 100 MM NH4CL, 6 MM BETA- MERCAPTOETHANOL, 0.8 MM SPERMIDINE, 0.6 MM SPERMINE |
| 試料 | 濃度: 1.3 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | 詳細: HOLEY CARBON |
急速凍結 | 装置: FEI VITROBOT MARK II / 凍結剤: ETHANE 詳細: VITRIFICATION 1 -- CRYOGEN- ETHANE, HUMIDITY- 80, INSTRUMENT - FEI VITROBOT MARK II, METHOD- BLOT FOR 2 SEC BEFORE PLUNGING, |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Tecnai F30 / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TECNAI F30 / 日付: 2008年9月22日 / 詳細: MINIMAL DOSE SYSTEM |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 39000 X / 倍率(補正後): 65520 X / 最大 デフォーカス(公称値): 4000 nm / 最小 デフォーカス(公称値): 2000 nm / Cs Bright-field microscopy / 倍率(公称値): 39000 X / 倍率(補正後): 65520 X / 最大 デフォーカス(公称値): 4000 nm / 最小 デフォーカス(公称値): 2000 nm / Cs : 2 mm : 2 mm |
| 撮影 | 電子線照射量: 20 e/Å2 / フィルム・検出器のモデル: KODAK SO-163 FILM |
| 画像スキャン | デジタル画像の数: 230 |
| 放射波長 | 相対比: 1 |
- 解析
解析
| EMソフトウェア |
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | 詳細: DEFOCUS GROUP | |||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | |||||||||||||||
3次元再構成 | 手法: MULTI-REFERENCE TEMPLATE MATCHING / 解像度: 8.9 Å / 粒子像の数: 52686 / ピクセルサイズ(公称値): 1.26 Å / ピクセルサイズ(実測値): 1.26 Å / 倍率補正: CROSS- -CORRELATION WITH KNOWN STRUCTURE 詳細: SUBMISSION BASED ON EXPERIMENTAL DATA FROM EMDB EMD -2624. (DEPOSITION ID: 12412). 対称性のタイプ: POINT | |||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL / Target criteria: Cross-correlation coefficient / 詳細: METHOD--RIGID BODY | |||||||||||||||
| 精密化 | 最高解像度: 8.9 Å | |||||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 8.9 Å
|
 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj





































