登録情報 データベース : PDB / ID : 4bv5タイトル Identification of small molecule inhibitors selective for apo(a) kringles KIV-7, KIV-10 and KV. APOLIPOPROTEIN(A) キーワード / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 HOMO SAPIENS (ヒト)手法 / / 解像度 : 2.1 Å データ登録者 Sandmark, J. / Althage, M. / Andersson, G.M.K. / Antonsson, T. / Blaho, S. / Bodin, C. / Bostrom, J. / Chen, Y. / Dahlen, A. / Eriksson, P.O. ...Sandmark, J. / Althage, M. / Andersson, G.M.K. / Antonsson, T. / Blaho, S. / Bodin, C. / Bostrom, J. / Chen, Y. / Dahlen, A. / Eriksson, P.O. / Evertsson, E. / Fex, T. / Fjellstrom, O. / Gustafsson, D. / Hallberg, C. / Hicks, R. / Jarkvist, E. / Johansson, C. / Kalies, I. / Kang, D. / Svalstedt Karlsson, B. / Kartberg, F. / Legnehed, A. / Lindqvist, A.M. / Martinsson, S.A. / Moberg, A. / Petersson, A.U. / Ridderstrom, M. / Thelin, A. / Tigerstrom, A. / Vinblad, J. / Xu, B. / Knecht, W. ジャーナル : To be Published タイトル : Small Molecules Used to Decipher the Pathophysiological Roles of the Kringle Domains Kiv-7, - 10 and Kv of Apolipoprotein(A)著者: Sandmark, J. / Althage, M. / Andersson, G.M.K. / Antonsson, T. / Blaho, S. / Bodin, C. / Bostrom, J. / Chen, Y. / Dahlen, A. / Eriksson, P.O. / Evertsson, E. / Fex, T. / Fjellstrom, O. / ... 著者 : Sandmark, J. / Althage, M. / Andersson, G.M.K. / Antonsson, T. / Blaho, S. / Bodin, C. / Bostrom, J. / Chen, Y. / Dahlen, A. / Eriksson, P.O. / Evertsson, E. / Fex, T. / Fjellstrom, O. / Gustafsson, D. / Hallberg, C. / Hicks, R. / Jarkvist, E. / Johansson, C. / Kalies, I. / Kang, D. / Svalstedt Karlsson, B. / Kartberg, F. / Legnehed, A. / Lindqvist, A.M. / Martinsson, S.A. / Moberg, A. / Petersson, A.U. / Ridderstrom, M. / Thelin, A. / Tigerstrom, A. / Vinblad, J. / Xu, B. / Knecht, W. 履歴 登録 2013年6月25日 登録サイト / 処理サイト 改定 1.0 2014年7月9日 Provider / タイプ 改定 1.1 2018年4月4日 Group / カテゴリ / Item 改定 1.2 2023年12月20日 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Other / Refinement description カテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_initial_refinement_model / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード HYDROLASE (加水分解酵素) /
HYDROLASE (加水分解酵素) /  CARDIOVASCULAR DISEASE (心血管疾患) / OPTICAL BIOSENSORS
CARDIOVASCULAR DISEASE (心血管疾患) / OPTICAL BIOSENSORS 機能・相同性情報
機能・相同性情報 リポタンパク質 / LDL remodeling /
リポタンパク質 / LDL remodeling /  循環器 / lipid transport /
循環器 / lipid transport /  endopeptidase inhibitor activity /
endopeptidase inhibitor activity /  apolipoprotein binding /
apolipoprotein binding /  fibronectin binding /
fibronectin binding /  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / lipid metabolic process /
加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / lipid metabolic process /  heparin binding ...
heparin binding ... リポタンパク質 / LDL remodeling /
リポタンパク質 / LDL remodeling /  循環器 / lipid transport /
循環器 / lipid transport /  endopeptidase inhibitor activity /
endopeptidase inhibitor activity /  apolipoprotein binding /
apolipoprotein binding /  fibronectin binding /
fibronectin binding /  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / lipid metabolic process /
加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / lipid metabolic process /  heparin binding /
heparin binding /  endopeptidase activity /
endopeptidase activity /  signaling receptor binding / serine-type endopeptidase activity /
signaling receptor binding / serine-type endopeptidase activity /  タンパク質分解 /
タンパク質分解 /  extracellular space / extracellular region
extracellular space / extracellular region
 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 2.1 Å
分子置換 / 解像度: 2.1 Å  データ登録者
データ登録者 引用
引用 ジャーナル: To be Published
ジャーナル: To be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4bv5.cif.gz
4bv5.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4bv5.ent.gz
pdb4bv5.ent.gz PDB形式
PDB形式 4bv5.json.gz
4bv5.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/bv/4bv5
https://data.pdbj.org/pub/pdb/validation_reports/bv/4bv5 ftp://data.pdbj.org/pub/pdb/validation_reports/bv/4bv5
ftp://data.pdbj.org/pub/pdb/validation_reports/bv/4bv5 リンク
リンク 集合体
集合体
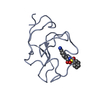
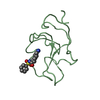
 :
:  要素
要素
 HOMO SAPIENS (ヒト) / プラスミド: PPICZALPHA / 発現宿主:
HOMO SAPIENS (ヒト) / プラスミド: PPICZALPHA / 発現宿主: 
 KOMAGATAELLA PASTORIS (菌類) / 株 (発現宿主): X-33
KOMAGATAELLA PASTORIS (菌類) / 株 (発現宿主): X-33 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ
加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 回転陽極 / タイプ: RIGAKU FR-E+ / 波長: 1.5418
回転陽極 / タイプ: RIGAKU FR-E+ / 波長: 1.5418  : 1.5418 Å / 相対比: 1
: 1.5418 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj



