| 登録情報 | データベース: PDB / ID: 1v7x
|
|---|
| タイトル | Crystal structure of Vibrio proteolyticus chitobiose phosphorylase in complex with GlcNAc and sulfate |
|---|
 要素 要素 | chitobiose phosphorylase |
|---|
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  beta-sandwich / (alpha/alpha)6 barrel beta-sandwich / (alpha/alpha)6 barrel |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
 N,N'-diacetylchitobiose phosphorylase / N,N'-diacetylchitobiose phosphorylase /  glycosyltransferase activity / glycosyltransferase activity /  carbohydrate binding / carbohydrate metabolic process / carbohydrate binding / carbohydrate metabolic process /  metal ion binding類似検索 - 分子機能 metal ion binding類似検索 - 分子機能 N,N'-diacetylchitobiose phosphorylase, N-terminal / N,N'-diacetylchitobiose phosphorylase, N-terminal /  Glycoside hydrolase, family 65, N-terminal domain / Glycoside hydrolase, family 65, N-terminal domain /  Maltose phosphorylase, domain 3 / Maltose phosphorylase, domain 3 /  Maltose phosphorylase, domain 3 / Putative carbohydrate binding domain / Putative carbohydrate binding domain / Maltose phosphorylase, domain 3 / Putative carbohydrate binding domain / Putative carbohydrate binding domain /  Glycosyl hydrolase 94 / Glycosyltransferase family 36 / Glycosyl hydrolase 94 / Glycosyltransferase family 36 /  Glycosyl hydrolase 36, catalytic domain / Glycosyl hydrolase 36 superfamily, catalytic domain ... Glycosyl hydrolase 36, catalytic domain / Glycosyl hydrolase 36 superfamily, catalytic domain ... N,N'-diacetylchitobiose phosphorylase, N-terminal / N,N'-diacetylchitobiose phosphorylase, N-terminal /  Glycoside hydrolase, family 65, N-terminal domain / Glycoside hydrolase, family 65, N-terminal domain /  Maltose phosphorylase, domain 3 / Maltose phosphorylase, domain 3 /  Maltose phosphorylase, domain 3 / Putative carbohydrate binding domain / Putative carbohydrate binding domain / Maltose phosphorylase, domain 3 / Putative carbohydrate binding domain / Putative carbohydrate binding domain /  Glycosyl hydrolase 94 / Glycosyltransferase family 36 / Glycosyl hydrolase 94 / Glycosyltransferase family 36 /  Glycosyl hydrolase 36, catalytic domain / Glycosyl hydrolase 36 superfamily, catalytic domain / Glycoside hydrolase family 65, N-terminal domain superfamily / Glycosyltransferase - #10 / Glycosyl hydrolase 36, catalytic domain / Glycosyl hydrolase 36 superfamily, catalytic domain / Glycoside hydrolase family 65, N-terminal domain superfamily / Glycosyltransferase - #10 /  Beta-galactosidase; Chain A, domain 5 / Galactose mutarotase-like domain superfamily / Six-hairpin glycosidase-like superfamily / Six-hairpin glycosidase superfamily / Beta-galactosidase; Chain A, domain 5 / Galactose mutarotase-like domain superfamily / Six-hairpin glycosidase-like superfamily / Six-hairpin glycosidase superfamily /  グリコシルトランスフェラーゼ / Alpha/alpha barrel / Distorted Sandwich / グリコシルトランスフェラーゼ / Alpha/alpha barrel / Distorted Sandwich /  サンドイッチ / Mainly Beta / Mainly Alpha類似検索 - ドメイン・相同性 サンドイッチ / Mainly Beta / Mainly Alpha類似検索 - ドメイン・相同性2-acetamido-2-deoxy-alpha-D-glucopyranose /  N,N'-diacetylchitobiose phosphorylase類似検索 - 構成要素 N,N'-diacetylchitobiose phosphorylase類似検索 - 構成要素 |
|---|
| 生物種 |  Vibrio proteolyticus (バクテリア) Vibrio proteolyticus (バクテリア) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多波長異常分散 / 解像度: 2 Å 多波長異常分散 / 解像度: 2 Å |
|---|
 データ登録者 データ登録者 | Hidaka, M. / Honda, Y. / Nirasawa, S. / Kitaoka, M. / Hayashi, K. / Wakagi, T. / Shoun, H. / Fushinobu, S. |
|---|
 引用 引用 |  ジャーナル: Structure / 年: 2004タイトル ジャーナル: Structure / 年: 2004タイトル: Chitobiose phosphorylase from Vibrio proteolyticus, a member of glycosyl transferase family 36, has a clan GH-L-like (alpha/alpha)(6) barrel fold. 著者: Hidaka, M. / Honda, Y. / Kitaoka, M. / Nirasawa, S. / Hayashi, K. / Wakagi, T. / Shoun, H. / Fushinobu, S. |
|---|
| 履歴 | | 登録 | 2003年12月24日 | 登録サイト: PDBJ / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2004年6月22日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月27日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Derived calculations / Version format compliance |
|---|
| 改定 2.0 | 2020年7月29日 | Group: Atomic model / Data collection ...Atomic model / Data collection / Database references / Derived calculations / Structure summary
カテゴリ: atom_site / chem_comp ...atom_site / chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _atom_site.auth_atom_id / _atom_site.label_atom_id ..._atom_site.auth_atom_id / _atom_site.label_atom_id / _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr1_symmetry / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.ptnr3_symmetry / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr1_symmetry / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_conn.ptnr2_symmetry / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 2.1 | 2023年12月27日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード TRANSFERASE (転移酵素) /
TRANSFERASE (転移酵素) /  beta-sandwich / (alpha/alpha)6 barrel
beta-sandwich / (alpha/alpha)6 barrel 機能・相同性情報
機能・相同性情報 N,N'-diacetylchitobiose phosphorylase /
N,N'-diacetylchitobiose phosphorylase /  glycosyltransferase activity /
glycosyltransferase activity /  carbohydrate binding / carbohydrate metabolic process /
carbohydrate binding / carbohydrate metabolic process /  metal ion binding
metal ion binding Vibrio proteolyticus (バクテリア)
Vibrio proteolyticus (バクテリア) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  多波長異常分散 / 解像度: 2 Å
多波長異常分散 / 解像度: 2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2004
ジャーナル: Structure / 年: 2004 ジャーナル: Biochem.J. / 年: 2004
ジャーナル: Biochem.J. / 年: 2004 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1v7x.cif.gz
1v7x.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1v7x.ent.gz
pdb1v7x.ent.gz PDB形式
PDB形式 1v7x.json.gz
1v7x.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/v7/1v7x
https://data.pdbj.org/pub/pdb/validation_reports/v7/1v7x ftp://data.pdbj.org/pub/pdb/validation_reports/v7/1v7x
ftp://data.pdbj.org/pub/pdb/validation_reports/v7/1v7x リンク
リンク 集合体
集合体

 要素
要素 Vibrio proteolyticus (バクテリア)
Vibrio proteolyticus (バクテリア)
 Escherichia coli (大腸菌) / 株 (発現宿主): BL21GOLD(DE3)
Escherichia coli (大腸菌) / 株 (発現宿主): BL21GOLD(DE3) 転移酵素; グリコシル基を移すもの; 六炭糖残基を移すもの
転移酵素; グリコシル基を移すもの; 六炭糖残基を移すもの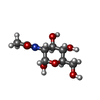


 N-アセチルグルコサミン
N-アセチルグルコサミン N-アセチルグルコサミン
N-アセチルグルコサミン




 硫酸塩
硫酸塩 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  Photon Factory
Photon Factory  / ビームライン: AR-NW12A / 波長: 1.0000, 0.97120, 0.97848, 0.97960
/ ビームライン: AR-NW12A / 波長: 1.0000, 0.97120, 0.97848, 0.97960 解析
解析 :
:  多波長異常分散 / 解像度: 2→47.69 Å / Rfactor Rfree error: 0.004 / Data cutoff high absF: 2461464.32 / Data cutoff low absF: 0 / Isotropic thermal model: ISOTROPIC / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
多波長異常分散 / 解像度: 2→47.69 Å / Rfactor Rfree error: 0.004 / Data cutoff high absF: 2461464.32 / Data cutoff low absF: 0 / Isotropic thermal model: ISOTROPIC / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj