| 登録情報 | データベース: PDB / ID: 1gz4
|
|---|
| タイトル | molecular mechanism of the regulation of human mitochondrial NAD(P)+-dependent malic enzyme by ATP and fumarate |
|---|
 要素 要素 | NAD-DEPENDENT MALIC ENZYME |
|---|
 キーワード キーワード |  OXIDOREDUCTASE (酸化還元酵素) / OXIDOREDUCTASE (酸化還元酵素) /  ALLOSTERIC REGULATION (アロステリック効果) / ALLOSTERIC REGULATION (アロステリック効果) /  ENERGY METABOLISM / KINETICS ENERGY METABOLISM / KINETICS |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
 リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity / リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity /  malic enzyme activity / malic enzyme activity /  oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding ... oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding ... リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity / リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity /  malic enzyme activity / malic enzyme activity /  oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding / oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding /  electron transfer activity / electron transfer activity /  ミトコンドリアマトリックス / intracellular membrane-bounded organelle / ミトコンドリアマトリックス / intracellular membrane-bounded organelle /  ミトコンドリア / ミトコンドリア /  metal ion binding類似検索 - 分子機能 metal ion binding類似検索 - 分子機能 Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, conserved site / Malic enzymes signature. / Malic oxidoreductase / Malic enzyme, conserved site / Malic enzymes signature. / Malic oxidoreductase /  Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, NAD-binding / Malic enzyme, NAD-binding /  Malic enzyme, N-terminal domain superfamily / Malic enzyme, N-terminal domain superfamily /  Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, NAD binding domain ... Malic enzyme, NAD binding domain ... Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, conserved site / Malic enzymes signature. / Malic oxidoreductase / Malic enzyme, conserved site / Malic enzymes signature. / Malic oxidoreductase /  Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, NAD-binding / Malic enzyme, NAD-binding /  Malic enzyme, N-terminal domain superfamily / Malic enzyme, N-terminal domain superfamily /  Malic enzyme, N-terminal domain / Malic enzyme, N-terminal domain /  Malic enzyme, NAD binding domain / Malic enzyme, NAD binding domain /  Malic enzyme, NAD binding domain / Aminoacid dehydrogenase-like, N-terminal domain superfamily / NAD(P)-binding Rossmann-like Domain / NAD(P)-binding domain superfamily / Malic enzyme, NAD binding domain / Aminoacid dehydrogenase-like, N-terminal domain superfamily / NAD(P)-binding Rossmann-like Domain / NAD(P)-binding domain superfamily /  ロスマンフォールド / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 ロスマンフォールド / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性ADENOSINE-5'-TRIPHOSPHATE /  フマル酸 / フマル酸 /  : / TARTRONATE / NAD-dependent malic enzyme, mitochondrial類似検索 - 構成要素 : / TARTRONATE / NAD-dependent malic enzyme, mitochondrial類似検索 - 構成要素 |
|---|
| 生物種 |   HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.2 Å 分子置換 / 解像度: 2.2 Å |
|---|
 データ登録者 データ登録者 | Yang, Z. / Lanks, C.W. / Tong, L. |
|---|
 引用 引用 |  ジャーナル: Structure / 年: 2002 ジャーナル: Structure / 年: 2002
タイトル: Molecular Mechanism for the Regulation of Human Mitochondrial Nad(P)(+)-Dependent Malic Enzyme by ATP and Fumarate
著者: Yang, Z. / Lanks, C.W. / Tong, L. |
|---|
| 履歴 | | 登録 | 2002年5月15日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2002年7月25日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年11月23日 | Group: Derived calculations / Non-polymer description ...Derived calculations / Non-polymer description / Other / Refinement description / Structure summary / Version format compliance |
|---|
| 改定 2.0 | 2023年11月15日 | Group: Atomic model / Data collection ...Atomic model / Data collection / Database references / Derived calculations
カテゴリ: atom_site / chem_comp_atom ...atom_site / chem_comp_atom / chem_comp_bond / database_2 / pdbx_struct_conn_angle / struct_conn / struct_site
Item: _atom_site.auth_atom_id / _atom_site.label_atom_id ..._atom_site.auth_atom_id / _atom_site.label_atom_id / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード OXIDOREDUCTASE (酸化還元酵素) /
OXIDOREDUCTASE (酸化還元酵素) /  ALLOSTERIC REGULATION (アロステリック効果) /
ALLOSTERIC REGULATION (アロステリック効果) /  ENERGY METABOLISM / KINETICS
ENERGY METABOLISM / KINETICS 機能・相同性情報
機能・相同性情報 リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity /
リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity /  malic enzyme activity /
malic enzyme activity /  oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding ...
oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding ... リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity /
リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) / regulation of NADP metabolic process / malate dehydrogenase (decarboxylating) (NAD+) activity / malate dehydrogenase (decarboxylating) (NADP+) activity /  malic enzyme activity /
malic enzyme activity /  oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding /
oxaloacetate decarboxylase activity / Citric acid cycle (TCA cycle) / malate metabolic process / pyruvate metabolic process / NAD binding /  electron transfer activity /
electron transfer activity /  ミトコンドリアマトリックス / intracellular membrane-bounded organelle /
ミトコンドリアマトリックス / intracellular membrane-bounded organelle /  ミトコンドリア /
ミトコンドリア /  metal ion binding
metal ion binding
 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.2 Å
分子置換 / 解像度: 2.2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2002
ジャーナル: Structure / 年: 2002 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1gz4.cif.gz
1gz4.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1gz4.ent.gz
pdb1gz4.ent.gz PDB形式
PDB形式 1gz4.json.gz
1gz4.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/gz/1gz4
https://data.pdbj.org/pub/pdb/validation_reports/gz/1gz4 ftp://data.pdbj.org/pub/pdb/validation_reports/gz/1gz4
ftp://data.pdbj.org/pub/pdb/validation_reports/gz/1gz4 リンク
リンク 集合体
集合体
 要素
要素
 HOMO SAPIENS (ヒト) / Organelle: MITOCHONDRION
HOMO SAPIENS (ヒト) / Organelle: MITOCHONDRION ミトコンドリア
ミトコンドリア リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) (NADP+)
リンゴ酸デヒドロゲナーゼ (オキサロ酢酸脱炭酸) (NADP+)
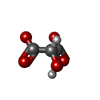

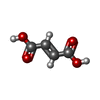





 アデノシン三リン酸
アデノシン三リン酸 フマル酸
フマル酸 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 32-ID / 波長: 0.97
/ ビームライン: 32-ID / 波長: 0.97  : 0.97 Å / 相対比: 1
: 0.97 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 : 0.242 / Rfactor Rwork
: 0.242 / Rfactor Rwork : 0.206
: 0.206  ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj



