+ データを開く
データを開く
- 基本情報
基本情報
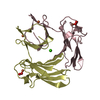
| 登録情報 | データベース: PDB / ID: 1cke | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | CMP KINASE FROM ESCHERICHIA COLI FREE ENZYME STRUCTURE | ||||||
 要素 要素 | PROTEIN (CYTIDINE MONOPHOSPHATE KINASE) | ||||||
 キーワード キーワード |  TRANSFERASE (転移酵素) / NUCLEOTIDE MONOPHOSPHATE KINASE TRANSFERASE (転移酵素) / NUCLEOTIDE MONOPHOSPHATE KINASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 (d)CMP kinase / (d)CMP kinase /  cytidylate kinase activity / cytidylate kinase activity /  CMP kinase activity / dCMP kinase activity / pyrimidine nucleotide metabolic process / nucleobase-containing small molecule interconversion / CMP kinase activity / dCMP kinase activity / pyrimidine nucleotide metabolic process / nucleobase-containing small molecule interconversion /  guanosine tetraphosphate binding / response to X-ray / guanosine tetraphosphate binding / response to X-ray /  リン酸化 / リン酸化 /  ATP binding / ATP binding /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単一同系置換・異常分散 / 解像度: 1.75 Å 単一同系置換・異常分散 / 解像度: 1.75 Å | ||||||
 データ登録者 データ登録者 | Briozzo, P. / Golinelli-Pimpaneau, B. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 1998 ジャーナル: Structure / 年: 1998タイトル: Structures of escherichia coli CMP kinase alone and in complex with CDP: a new fold of the nucleoside monophosphate binding domain and insights into cytosine nucleotide specificity. 著者: Briozzo, P. / Golinelli-Pimpaneau, B. / Gilles, A.M. / Gaucher, J.F. / Burlacu-Miron, S. / Sakamoto, H. / Janin, J. / Barzu, O. #1:  ジャーナル: J.Biol.Chem. / 年: 1996 ジャーナル: J.Biol.Chem. / 年: 1996タイトル: Cmp Kinase from Escherichia Coli is Structurally Related to Other Nucleoside Monophosphate Kinases 著者: Bucurenci, N. / Sakamoto, H. / Briozzo, P. / Palibroda, N. / Serina, L. / Sarfati, R.S. / Labesse, G. / Briand, G. / Danchin, A. / Barzu, O. / Gilles, A.M. #2:  ジャーナル: J.Bacteriol. / 年: 1995 ジャーナル: J.Bacteriol. / 年: 1995タイトル: The Cmk Gene Encoding Cytidine Monophosphate Kinase is Located in the rspA Operon and is Required for Normal Replication Rate in Escherichia Coli 著者: Fricke, J. / Neuhard, J. / Kelln, R.A. / Pedersen, S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1cke.cif.gz 1cke.cif.gz | 56.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1cke.ent.gz pdb1cke.ent.gz | 40.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1cke.json.gz 1cke.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ck/1cke https://data.pdbj.org/pub/pdb/validation_reports/ck/1cke ftp://data.pdbj.org/pub/pdb/validation_reports/ck/1cke ftp://data.pdbj.org/pub/pdb/validation_reports/ck/1cke | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 24748.352 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Escherichia coli (大腸菌) / 発現宿主: Escherichia coli (大腸菌) / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P0A6I0, UMP/CMP kinase Escherichia coli (大腸菌) / 参照: UniProt: P0A6I0, UMP/CMP kinase |
|---|---|
| #2: 化合物 | ChemComp-SO4 /  硫酸塩 硫酸塩 |
| #3: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.44 Å3/Da / 溶媒含有率: 49 % | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | pH: 7.4 / 詳細: pH 7.4 | ||||||||||||||||||
| 結晶化 | *PLUS 温度: 20 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 290 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: LURE シンクロトロン / サイト: LURE  / ビームライン: DW32 / 波長: 0.97 / ビームライン: DW32 / 波長: 0.97 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1996年10月7日 |
| 放射 | モノクロメーター: GRAPHITE / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.97 Å / 相対比: 1 : 0.97 Å / 相対比: 1 |
| 反射 | 解像度: 1.75→30 Å / Num. obs: 23804 / % possible obs: 98.8 % / Observed criterion σ(I): 0 / 冗長度: 7.8 % / Rsym value: 0.06 / Net I/σ(I): 22.9 |
| 反射 シェル | 解像度: 1.75→1.81 Å / Mean I/σ(I) obs: 3.6 / Rsym value: 0.395 / % possible all: 99.6 |
| 反射 | *PLUS Num. measured all: 185661 / Rmerge(I) obs: 0.06 |
| 反射 シェル | *PLUS % possible obs: 99.6 % / Rmerge(I) obs: 0.395 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  単一同系置換・異常分散 / 解像度: 1.75→7 Å / σ(F): 2 単一同系置換・異常分散 / 解像度: 1.75→7 Å / σ(F): 2 詳細: SIDE CHAIN FROM RESIDUE ARG 173 WAS NOT WELL DEFINED IN THE DENSITY AND WAS MODELED BY STEREOCHEMISTRY
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 33.6 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.75→7 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.84 / 分類: refinement X-PLOR / バージョン: 3.84 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最低解像度: 7 Å / σ(F): 2 / % reflection Rfree: 10 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 33.6 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj


