+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9244 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
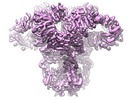
| タイトル | Structure of full-length IP3R1 channel in Apo-state (composite) | |||||||||||||||||||||
 マップデータ マップデータ | cryoEM structure of IP3R1 in an apo state | |||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Effects of PIP2 hydrolysis / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / inositol 1,4,5-trisphosphate receptor activity involved in regulation of postsynaptic cytosolic calcium levels / Elevation of cytosolic Ca2+ levels / cGMP effects / smooth endoplasmic reticulum membrane / platelet dense tubular network / negative regulation of calcium-mediated signaling /  calcineurin complex / platelet dense granule membrane ...Effects of PIP2 hydrolysis / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / inositol 1,4,5-trisphosphate receptor activity involved in regulation of postsynaptic cytosolic calcium levels / Elevation of cytosolic Ca2+ levels / cGMP effects / smooth endoplasmic reticulum membrane / platelet dense tubular network / negative regulation of calcium-mediated signaling / calcineurin complex / platelet dense granule membrane ...Effects of PIP2 hydrolysis / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / inositol 1,4,5-trisphosphate receptor activity involved in regulation of postsynaptic cytosolic calcium levels / Elevation of cytosolic Ca2+ levels / cGMP effects / smooth endoplasmic reticulum membrane / platelet dense tubular network / negative regulation of calcium-mediated signaling /  calcineurin complex / platelet dense granule membrane / epithelial fluid transport / ion channel modulating, G protein-coupled receptor signaling pathway / phospholipase C-activating G protein-coupled acetylcholine receptor signaling pathway / inositol 1,4,5-trisphosphate-gated calcium channel activity / regulation of postsynaptic cytosolic calcium ion concentration / voluntary musculoskeletal movement / calcineurin complex / platelet dense granule membrane / epithelial fluid transport / ion channel modulating, G protein-coupled receptor signaling pathway / phospholipase C-activating G protein-coupled acetylcholine receptor signaling pathway / inositol 1,4,5-trisphosphate-gated calcium channel activity / regulation of postsynaptic cytosolic calcium ion concentration / voluntary musculoskeletal movement /  inositol 1,4,5 trisphosphate binding / positive regulation of calcium ion transport / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / endoplasmic reticulum calcium ion homeostasis / positive regulation of hepatocyte proliferation / nuclear inner membrane / transport vesicle membrane / Ion homeostasis / dendrite development / intracellularly gated calcium channel activity / ligand-gated ion channel signaling pathway / GABA-ergic synapse / intrinsic apoptotic signaling pathway in response to endoplasmic reticulum stress / calcium channel inhibitor activity / cellular response to cAMP / release of sequestered calcium ion into cytosol / inositol 1,4,5 trisphosphate binding / positive regulation of calcium ion transport / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / endoplasmic reticulum calcium ion homeostasis / positive regulation of hepatocyte proliferation / nuclear inner membrane / transport vesicle membrane / Ion homeostasis / dendrite development / intracellularly gated calcium channel activity / ligand-gated ion channel signaling pathway / GABA-ergic synapse / intrinsic apoptotic signaling pathway in response to endoplasmic reticulum stress / calcium channel inhibitor activity / cellular response to cAMP / release of sequestered calcium ion into cytosol /  phosphatidylinositol binding / post-embryonic development / secretory granule membrane / phosphatidylinositol binding / post-embryonic development / secretory granule membrane /  筋小胞体 / 筋小胞体 /  synaptic membrane / synaptic membrane /  liver regeneration / calcium-mediated signaling / calcium ion transmembrane transport / Schaffer collateral - CA1 synapse / cell morphogenesis / positive regulation of neuron projection development / positive regulation of insulin secretion / calcium ion transport / presynapse / liver regeneration / calcium-mediated signaling / calcium ion transmembrane transport / Schaffer collateral - CA1 synapse / cell morphogenesis / positive regulation of neuron projection development / positive regulation of insulin secretion / calcium ion transport / presynapse /  核膜 / phospholipase C-activating G protein-coupled receptor signaling pathway / positive regulation of cytosolic calcium ion concentration / cellular response to hypoxia / postsynapse / 核膜 / phospholipase C-activating G protein-coupled receptor signaling pathway / positive regulation of cytosolic calcium ion concentration / cellular response to hypoxia / postsynapse /  protein phosphatase binding / transmembrane transporter binding / protein phosphatase binding / transmembrane transporter binding /  postsynaptic density / response to hypoxia / positive regulation of apoptotic process / protein domain specific binding / postsynaptic density / response to hypoxia / positive regulation of apoptotic process / protein domain specific binding /  樹状突起 / neuronal cell body / 樹状突起 / neuronal cell body /  シナプス / シナプス /  calcium ion binding / protein-containing complex binding / endoplasmic reticulum membrane / calcium ion binding / protein-containing complex binding / endoplasmic reticulum membrane /  核小体 / negative regulation of apoptotic process / perinuclear region of cytoplasm / 核小体 / negative regulation of apoptotic process / perinuclear region of cytoplasm /  小胞体 / protein-containing complex / 小胞体 / protein-containing complex /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 / 細胞膜 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |   Rattus norvegicus (ドブネズミ) / Rattus norvegicus (ドブネズミ) /   Rat (クマネズミ属) Rat (クマネズミ属) | |||||||||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.9 Å クライオ電子顕微鏡法 / 解像度: 3.9 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Serysheva II / Fan G / Baker MR / Wang Z / Seryshev A / Ludtke SJ / Baker ML | |||||||||||||||||||||
| 資金援助 |  米国, 6件 米国, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Cell Res / 年: 2018 ジャーナル: Cell Res / 年: 2018タイトル: Cryo-EM reveals ligand induced allostery underlying InsPR channel gating. 著者: Guizhen Fan / Mariah R Baker / Zhao Wang / Alexander B Seryshev / Steven J Ludtke / Matthew L Baker / Irina I Serysheva /  要旨: Inositol-1,4,5-trisphosphate receptors (InsPRs) are cation channels that mobilize Ca from intracellular stores in response to a wide range of cellular stimuli. The paradigm of InsPR activation is the ...Inositol-1,4,5-trisphosphate receptors (InsPRs) are cation channels that mobilize Ca from intracellular stores in response to a wide range of cellular stimuli. The paradigm of InsPR activation is the coupled interplay between binding of InsP and Ca that switches the ion conduction pathway between closed and open states to enable the passage of Ca through the channel. However, the molecular mechanism of how the receptor senses and decodes ligand-binding signals into gating motion remains unknown. Here, we present the electron cryo-microscopy structure of InsPR1 from rat cerebellum determined to 4.1 Å resolution in the presence of activating concentrations of Ca and adenophostin A (AdA), a structural mimetic of InsP and the most potent known agonist of the channel. Comparison with the 3.9 Å-resolution structure of InsPR1 in the Apo-state, also reported herein, reveals the binding arrangement of AdA in the tetrameric channel assembly and striking ligand-induced conformational rearrangements within cytoplasmic domains coupled to the dilation of a hydrophobic constriction at the gate. Together, our results provide critical insights into the mechanistic principles by which ligand-binding allosterically gates InsPR channel. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9244.map.gz emd_9244.map.gz | 28 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9244-v30.xml emd-9244-v30.xml emd-9244.xml emd-9244.xml | 18.3 KB 18.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_9244.png emd_9244.png | 224.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9244 http://ftp.pdbj.org/pub/emdb/structures/EMD-9244 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9244 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9244 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9244.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9244.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cryoEM structure of IP3R1 in an apo state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.26 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Inositol 1,4,5-trisphosphate receptor
| 全体 | 名称: Inositol 1,4,5-trisphosphate receptor |
|---|---|
| 要素 |
|
-超分子 #1: Inositol 1,4,5-trisphosphate receptor
| 超分子 | 名称: Inositol 1,4,5-trisphosphate receptor / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: tetrameric assembly |
|---|---|
| 由来(天然) | 生物種:   Rattus norvegicus (ドブネズミ) / 器官: Brain / 組織: Cerebellum / Organelle: endoplasmic reticulum / 細胞中の位置: membrane Rattus norvegicus (ドブネズミ) / 器官: Brain / 組織: Cerebellum / Organelle: endoplasmic reticulum / 細胞中の位置: membrane |
| 分子量 | 理論値: 1.3 MDa |
-分子 #1: Inositol 1,4,5-trisphosphate receptor type 1
| 分子 | 名称: Inositol 1,4,5-trisphosphate receptor type 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Rat (クマネズミ属) / 器官: Brain / 組織: cerebellum Rat (クマネズミ属) / 器官: Brain / 組織: cerebellum |
| 分子量 | 理論値: 313.657406 KDa |
| 配列 | 文字列: MSDKMSSFLH IGDICSLYAE GSTNGFISTL GLVDDRCVVQ PEAGDLNNPP KKFRDCLFKL CPMNRYSAQK QFWKAAKPGA NSTTDAVLL NKLHHAADLE KKQNETENRK LLGTVIQYGN VIQLLHLKSN KYLTVNKRLP ALLEKNAMRV TLDEAGNEGS W FYIQPFYK ...文字列: MSDKMSSFLH IGDICSLYAE GSTNGFISTL GLVDDRCVVQ PEAGDLNNPP KKFRDCLFKL CPMNRYSAQK QFWKAAKPGA NSTTDAVLL NKLHHAADLE KKQNETENRK LLGTVIQYGN VIQLLHLKSN KYLTVNKRLP ALLEKNAMRV TLDEAGNEGS W FYIQPFYK LRSIGDSVVI GDKVVLNPVN AGQPLHASSH QLVDNPGCNE VNSVNCNTSW KIVLFMKWSD NKDDILKGGD VV RLFHAEQ EKFLTCDEHR KKQHVFLRTT GRQSATSATS SKALWEVEVV QHDPCRGGAG YWNSLFRFKH LATGHYLAAE VDP DFEEEC LEFQPSVDPD QDASRSRLRN AQEKMVYSLV SVPEGNDISS IFELDPTTLR GGDSLVPRNS YVRLRHLCTN TWVH STNIP IDKEEEKPVM LKIGTSPLKE DKEAFAIVPV SPAEVRDLDF ANDASKVLGS IAGKLEKGTI TQNERRSVTK LLEDL VYFV TGGTNSGQDV LEVVFSKPNR ERQKLMREQN ILKQIFKLLQ APFTDCGDGP MLRLEELGDQ RHAPFRHICR LCYRVL RHS QQDYRKNQEY IAKQFGFMQK QIGYDVLAED TITALLHNNR KLLEKHITAA EIDTFVSLVR KNREPRFLDY LSDLCVS MN KSIPVTQELI CKAVLNPTNA DILIETKLVL SRFEFEGVST GENALEAGED EEEVWLFWRD SNKEIRSKSV RELAQDAK E GQKEDRDVLS YYRYQLNLFA RMCLDRQYLA INEISGQLDV DLILRCMSDE NLPYDLRASF CRLMLHMHVD RDPQEQVTP VKYARLWSEI PSEIAIDDYD SSGASKDEIK ERFAQTMEFV EEYLRDVVCQ RFPFSDKEKN KLTFEVVNLA RNLIYFGFYN FSDLLRLTK ILLAILDCVH VTTIFPISKM TKGEENKGSN VMRSIHGVGE LMTQVVLRGG GFLPMTPMAA APEGNVKQAE P EKEDIMVM DTKLKIIEIL QFILNVRLDY RISCLLCIFK REFDESNSQS SETSSGNSSQ EGPSNVPGAL DFEHIEEQAE GI FGGSEEN TPLDLDDHGG RTFLRVLLHL TMHDYPPLVS GALQLLFRHF SQRQEVLQAF KQVQLLVTSQ DVDNYKQIKQ DLD QLRSIV EKSELWVYKG QGPDEPMDGA SGENEHKKTE EGTSKPLKHE STSSYNYRVV KEILIRLSKL CVQESASVRK SRKQ QQRLL RNMGAHAVVL ELLQIPYEKA EDTKMQEIMR LAHEFLQNFC AGNQQNQALL HKHINLFLNP GILEAVTMQH IFMNN FQLC SEINERVVQH FVHCIETHGR NVQYIKFLQT IVKAEGKFIK KCQDMVMAEL VNSGEDVLVF YNDRASFQTL IQMMRS ERD RMDENSPLFM YHIHLVELLA VCTEGKNVYT EIKCNSLLPL DDIVRVVTHE DCIPEVKIAY INFLNHCYVD TEVEMKE IY TSNHMWKLFE NFLVDICRAC NNTSDRKHAD SVLEKYVTEI VMSIVTTFFS SPFSDQSTTL QTRQPVFVQL LQGVFRVY H CNWLMPSQKA SVESCIRVLS DVAKSRAIAI PVDLDSQVNN LFLKSHNIVQ KTAMNWRLSA RNAARRDSVL AASRDYRNI IERLQDIVSA LEDRLRPLVQ AELSVLVDVL HRPELLFPEN TDARRKCESG GFICKLIKHT KQLLEENEEK LCIKVLQTLR EMMTKDRGY GEKQISIDEL ENAELPQPPE AENSTEQELE PSPPLRQLED HKRGEALRQI LVNRYYGNIR PSGRRESLTS F GNGPLSPG GPSKPGGGGG GPGSGSTSRG EMSLAEVQCH LDKEGASNLV IDLIMNASSD RVFHESILLA IALLEGGNTT IQ HSFFCRL TEDKKSEKFF KVFYDRMKVA QQEIKATVTV NTSDLGNKKK DDEVDRDAPS RKKAKEPTTQ ITEEVRDQLL EAS AATRKA FTTFRREADP DDHYQSGEGT QATTDKAKDD LEMSAVITIM QPILRFLQLL CENHNRDLQN FLRCQNNKTN YNLV CETLQ FLDCICGSTT GGLGLLGLYI NEKNVALINQ TLESLTEYCQ GPCHENQNCI ATHESNGIDI ITALILNDIN PLGKK RMDL VLELKNNASK LLLAIMESRH DSENAERILY NMRPKELVEV IKKAYMQGEV EFEDGENGED GAASPRNVGH NIYILA HQL ARHNKELQTM LKPGGQVDGD EALEFYAKHT AQIEIVRLDR TMEQIVFPVP SICEFLTKES KLRIYYTTER DEQGSKI ND FFLRSEDLFN EMNWQKKLRA QPVLYWCARN MSFWSSISFN LAVLMNLLVA FFYPFKGVRG GTLEPHWSGL LWTAMLIS L AIVIALPKPH GIRALIASTI LRLIFSVGLQ PTLFLLGAFN VCNKIIFLMS FVGNCGTFTR GYRAMVLDVE FLYHLLYLL ICAMGLFVHE FFYSLLLFDL VYREETLLNV IKSVTRNGRP IILTAALALI LVYLFSIVGY LFFKDDFILE VDRLPNETAG PETGESLAN DFLYSDVCRV ETGENCTSPA PKEELLPVEE TEQDKEHTCE TLLMCIVTVL SHGLRSGGGV GDVLRKPSKE E PLFAARVI YDLLFFFMVI IIVLNLIFGV IIDTFADLRS EKQKKEEILK TTCFICGLER DKFDNKTVTF EEHIKEEHNM WH YLCFIVL VKVKDSTEYT GPESYVAEMI RERNLDWFPR MRAMSLVSSD SEGEQNELRN LQEKLESTMK LVTNLSGQLS ELK DQMTEQ RKQKQRIGLL GHPPHMNVNP QQPA |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 50 mM Tris-HCl buffer (pH 7.4), 150 mM NaCl, 1 mM DTT, 0.4% CHAPS, 2 mM EGTA, 1 mM EDTA, protease inhibitors |
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 293 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | Monodisperse sample |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F30 |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 試料ステージ | 試料ホルダーモデル: GATAN 910 MULTI-SPECIMEN SINGLE TILT CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
| 温度 | 最低: 93.0 K / 最高: 93.0 K |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 2-17 / 実像数: 9823 / 平均露光時間: 0.2 sec. / 平均電子線量: 1.3 e/Å2 |
| 実験機器 |  モデル: Tecnai F30 / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 207914 |
|---|---|
| CTF補正 | ソフトウェア - 名称: CTFFIND (ver. 3) |
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION (ver. 1.4) |
| 最終 3次元分類 | クラス数: 5 / ソフトウェア - 名称: RELION (ver. 1.4) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION (ver. 1.4) |
| 最終 再構成 | 想定した対称性 - 点群: C4 (4回回転対称 ) / 解像度のタイプ: BY AUTHOR / 解像度: 3.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 1.4) ) / 解像度のタイプ: BY AUTHOR / 解像度: 3.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 1.4)詳細: Image processing was performed independently using RELION and EMAN2 to near-atomic resolution in large regions of the structure. Local resolution assessment performed independently for each ...詳細: Image processing was performed independently using RELION and EMAN2 to near-atomic resolution in large regions of the structure. Local resolution assessment performed independently for each map revealed different domains were better resolved by each software package. To avoid human bias and extract the most information from each reconstruction the final map was a locally filtered average of the EMAN2 and RELION map. To combine the two maps, a local resolution filter, based on a windowed FSC local resolution assessment, was performed independently on the two maps. The two locally filtered maps were then averaged together. The local filtration determines the contribution of each map at each resolution in each region of the final composite map, permitting each map to dominate in regions where better self-consistency was obtained during refinement. 使用した粒子像数: 65438 |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-6mu2: |
 ムービー
ムービー コントローラー
コントローラー