+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8529 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
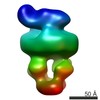
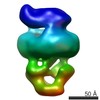
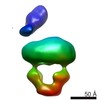
| タイトル | MalFGK2 ADP | |||||||||
 マップデータ マップデータ | MalFGK2 ADP | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ABC-type maltose transporter / ABC-type maltose transporter activity / negative regulation of maltose transport / enzyme IIA-maltose transporter complex / negative regulation of transmembrane transport / maltose transport complex / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / ATP-binding cassette (ABC) transporter complex ...ABC-type maltose transporter / ABC-type maltose transporter activity / negative regulation of maltose transport / enzyme IIA-maltose transporter complex / negative regulation of transmembrane transport / maltose transport complex / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / ATP-binding cassette (ABC) transporter complex / DNA-binding transcription factor binding / DNA damage response /  ATP hydrolysis activity / ATP hydrolysis activity /  ATP binding / ATP binding /  生体膜 / 生体膜 /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  ネガティブ染色法 / 解像度: 22.3 Å ネガティブ染色法 / 解像度: 22.3 Å | |||||||||
 データ登録者 データ登録者 | Fabre L / Bao H / Innes J / Duong F / Rouiller I | |||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2017 ジャーナル: J Biol Chem / 年: 2017タイトル: Negative Stain Single-particle EM of the Maltose Transporter in Nanodiscs Reveals Asymmetric Closure of MalK and Catalytic Roles of ATP, MalE, and Maltose. 著者: Lucien Fabre / Huan Bao / James Innes / Franck Duong / Isabelle Rouiller /  要旨: The MalE-MalFGK complex is one of the best characterized members of the large and ubiquitous family of ATP-binding cassette (ABC) transporters. It is composed of a membrane-spanning heterodimer, ...The MalE-MalFGK complex is one of the best characterized members of the large and ubiquitous family of ATP-binding cassette (ABC) transporters. It is composed of a membrane-spanning heterodimer, MalF-MalG; a homodimeric ATPase, MalK; and a periplasmic maltose receptor, MalE. Opening and closure of MalK is coupled to conformational changes in MalF-MalG and the alternate exposition of the substrate-binding site to either side of the membrane. To further define this alternate access mechanism and the impact of ATP, MalE, and maltose on the conformation of the transporter during the transport cycle, we have reconstituted MalFGK in nanodiscs and analyzed its conformations under 10 different biochemical conditions using negative stain single-particle EM. EM map results (at 15-25 Å resolution) indicate that binding of ATP to MalK promotes an asymmetric, semi-closed conformation in accordance with the low ATPase activity of MalFGK In the presence of MalE, the MalK dimer becomes fully closed, gaining the ability to hydrolyze ATP. In the presence of ADP or maltose, MalE·MalFGK remains essentially in a semi-closed symmetric conformation, indicating that release of these ligands is required for the return to the initial state. Taken together, this structural information provides a rationale for the stimulation of MalK ATPase activity by MalE as well as by maltose. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8529.map.gz emd_8529.map.gz | 5.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8529-v30.xml emd-8529-v30.xml emd-8529.xml emd-8529.xml | 13.3 KB 13.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_8529.png emd_8529.png | 70.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8529 http://ftp.pdbj.org/pub/emdb/structures/EMD-8529 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8529 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8529 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8529.map.gz / 形式: CCP4 / 大きさ: 6.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8529.map.gz / 形式: CCP4 / 大きさ: 6.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | MalFGK2 ADP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.23 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : MalFGK2 ADP
| 全体 | 名称: MalFGK2 ADP |
|---|---|
| 要素 |
|
-超分子 #1: MalFGK2 ADP
| 超分子 | 名称: MalFGK2 ADP / タイプ: complex / ID: 1 / 親要素: 0 / 詳細: Maltose Transporter MalFGK2 in complex with ADP |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌)組換プラスミド: pBAD22-FGK |
-実験情報
-構造解析
| 手法 |  ネガティブ染色法 ネガティブ染色法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.05 mg/mL | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| |||||||||||||||||||||
| 染色 | タイプ: NEGATIVE / 材質: Uranyl Formate / 詳細: Freshly prepared 1.5% uranyl formate (pH 5) | |||||||||||||||||||||
| グリッド | メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR | |||||||||||||||||||||
| 詳細 | MalFGK2 reconstituted in nanodiscs at a molar ratio MalFGK2:MSP1D1:lipid (DOPC)of 1:3:60. Incubated with ADP. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 134010 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 1.4 µm / 最小 デフォーカス(公称値): 0.7 µm Bright-field microscopy / 最大 デフォーカス(公称値): 1.4 µm / 最小 デフォーカス(公称値): 0.7 µm |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
| 撮影 | フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) 平均電子線量: 20.0 e/Å2 |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 12137 |
|---|---|
| CTF補正 | ソフトウェア - 名称: CTFFIND3 |
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: 詳細: MalFGK2 Apo low pass filtered at 60A |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: RELION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: RELION |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 22.3 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: RELION / 使用した粒子像数: 6382 |
 ムービー
ムービー コントローラー
コントローラー