+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8504 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the CTP synthase filament at 4.6 Angstrom resolution | |||||||||
 マップデータ マップデータ | CTP synthase filament | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 cytoophidium / CTP synthase (glutamine hydrolysing) / cytoophidium / CTP synthase (glutamine hydrolysing) /  CTP synthase activity / 'de novo' CTP biosynthetic process / pyrimidine nucleobase biosynthetic process / CTP synthase activity / 'de novo' CTP biosynthetic process / pyrimidine nucleobase biosynthetic process /  glutaminase activity / CTP biosynthetic process / glutamine metabolic process / protein homotetramerization / magnesium ion binding ... glutaminase activity / CTP biosynthetic process / glutamine metabolic process / protein homotetramerization / magnesium ion binding ... cytoophidium / CTP synthase (glutamine hydrolysing) / cytoophidium / CTP synthase (glutamine hydrolysing) /  CTP synthase activity / 'de novo' CTP biosynthetic process / pyrimidine nucleobase biosynthetic process / CTP synthase activity / 'de novo' CTP biosynthetic process / pyrimidine nucleobase biosynthetic process /  glutaminase activity / CTP biosynthetic process / glutamine metabolic process / protein homotetramerization / magnesium ion binding / protein-containing complex / glutaminase activity / CTP biosynthetic process / glutamine metabolic process / protein homotetramerization / magnesium ion binding / protein-containing complex /  ATP binding / identical protein binding / ATP binding / identical protein binding /  metal ion binding / metal ion binding /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.6 Å クライオ電子顕微鏡法 / 解像度: 4.6 Å | |||||||||
 データ登録者 データ登録者 | Kollman JM / Lynch EM | |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2017 ジャーナル: Nat Struct Mol Biol / 年: 2017タイトル: Human CTP synthase filament structure reveals the active enzyme conformation. 著者: Eric M Lynch / Derrick R Hicks / Matthew Shepherd / James A Endrizzi / Allison Maker / Jesse M Hansen / Rachael M Barry / Zemer Gitai / Enoch P Baldwin / Justin M Kollman /   要旨: The universally conserved enzyme CTP synthase (CTPS) forms filaments in bacteria and eukaryotes. In bacteria, polymerization inhibits CTPS activity and is required for nucleotide homeostasis. Here we ...The universally conserved enzyme CTP synthase (CTPS) forms filaments in bacteria and eukaryotes. In bacteria, polymerization inhibits CTPS activity and is required for nucleotide homeostasis. Here we show that for human CTPS, polymerization increases catalytic activity. The cryo-EM structures of bacterial and human CTPS filaments differ considerably in overall architecture and in the conformation of the CTPS protomer, explaining the divergent consequences of polymerization on activity. The structure of human CTPS filament, the first structure of the full-length human enzyme, reveals a novel active conformation. The filament structures elucidate allosteric mechanisms of assembly and regulation that rely on a conserved conformational equilibrium. The findings may provide a mechanism for increasing human CTPS activity in response to metabolic state and challenge the assumption that metabolic filaments are generally storage forms of inactive enzymes. Allosteric regulation of CTPS polymerization by ligands likely represents a fundamental mechanism underlying assembly of other metabolic filaments. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8504.map.gz emd_8504.map.gz | 116.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8504-v30.xml emd-8504-v30.xml emd-8504.xml emd-8504.xml | 11.3 KB 11.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_8504.png emd_8504.png | 140.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8504 http://ftp.pdbj.org/pub/emdb/structures/EMD-8504 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8504 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8504 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5u3cMC  8474C  8475C  8476C  8490C  8491C  8513C  5tkvC  5u03C  5u05C  5u6rC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8504.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8504.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CTP synthase filament | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.22 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
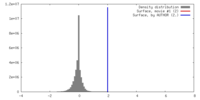
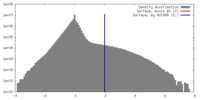
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : CTP synthase filament
| 全体 | 名称: CTP synthase filament |
|---|---|
| 要素 |
|
-超分子 #1: CTP synthase filament
| 超分子 | 名称: CTP synthase filament / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: CTP synthase was incubated in the presence of substrates, and filaments form as the product CTP builds up in the reaction. |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) / 組換プラスミド: pET22 Escherichia coli (大腸菌) / 組換プラスミド: pET22 |
-分子 #1: CTP synthase
| 分子 | 名称: CTP synthase / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: CTP synthase (glutamine hydrolysing) |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 分子量 | 理論値: 60.44698 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MTTNYIFVTG GVVSSLGKGI AAASLAAILE ARGLNVTIMK LDPYINVDPG TMSPIQHGEV FVTEDGAETD LDLGHYERFI RTKMSRRNN FTTGRIYSDV LRKERRGDYL GATVQVIPHI TNAIKERVLE GGEGHDVVLV EIGGTVGDIE SLPFLEAIRQ M AVEIGREH ...文字列: MTTNYIFVTG GVVSSLGKGI AAASLAAILE ARGLNVTIMK LDPYINVDPG TMSPIQHGEV FVTEDGAETD LDLGHYERFI RTKMSRRNN FTTGRIYSDV LRKERRGDYL GATVQVIPHI TNAIKERVLE GGEGHDVVLV EIGGTVGDIE SLPFLEAIRQ M AVEIGREH TLFMHLTLVP YMAASGEVKT KPTQHSVKEL LSIGIQPDIL ICRSDRAVPA NERAKIALFC NVPEKAVISL KD VDSIYKI PGLLKSQGLD DYICKRFSLN CPEANLSEWE QVIFEEANPV SEVTIGMVGK YIELPDAYKS VIEALKHGGL KNR VSVNIK LIDSQDVETR GVEILKGLDA ILVPGGFGYR GVEGMITTAR FARENNIPYL GICLGMQVAL IDYARHVANM ENAN STEFV PDCKYPVVAL ITEWRDENGN VEVRSEKSDL GGTMRLGAQQ CQLVDDSLVR QLYNAPTIVE RHRHRYEVNN MLLKQ IEDA GLRVAGRSGD DQLVEIIEVP NHPWFVACQF HPEFTSTPRD GHPLFAGFVK AASEFQKRQA K |
-分子 #2: CYTIDINE-5'-TRIPHOSPHATE
| 分子 | 名称: CYTIDINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 4 / 式: CTP |
|---|---|
| 分子量 | 理論値: 483.156 Da |
| Chemical component information | 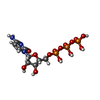 ChemComp-CTP: |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 4 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.85 mg/mL |
|---|---|
| 緩衝液 | pH: 7.8 |
| 凍結 | 凍結剤: ETHANE |
| 詳細 | E. coli CTP synthase bound to CTP and ADP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 34.0 e/Å2 |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER / 詳細: Cylinder |
|---|---|
| 最終 角度割当 | タイプ: NOT APPLICABLE / ソフトウェア - 名称: SPIDER |
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 81.6 Å 想定した対称性 - らせんパラメータ - ΔΦ: 48.5 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 4.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: SPIDER / 使用した粒子像数: 8622 |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)