+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6988 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | cryo-em structure of alpha-synuclein fiber | |||||||||
 マップデータ マップデータ | Density map calculated by applying a helical symmetry to the segments in the middle of 3D reconstruction. The twist angle is 179.64 degree and the rise is 3.39 angstrom. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | alpha-syn fiber /  Parkinson disease (パーキンソン病) / PROTEIN FIBRIL Parkinson disease (パーキンソン病) / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process /  regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process ...negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process / regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process ...negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process /  regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber / negative regulation of transporter activity / negative regulation of chaperone-mediated autophagy / mitochondrial membrane organization / regulation of reactive oxygen species biosynthetic process / positive regulation of protein localization to cell periphery / regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber / negative regulation of transporter activity / negative regulation of chaperone-mediated autophagy / mitochondrial membrane organization / regulation of reactive oxygen species biosynthetic process / positive regulation of protein localization to cell periphery /  regulation of synaptic vesicle recycling / negative regulation of platelet-derived growth factor receptor signaling pathway / negative regulation of exocytosis / regulation of glutamate secretion / response to iron(II) ion / regulation of norepinephrine uptake / dopamine biosynthetic process / regulation of synaptic vesicle recycling / negative regulation of platelet-derived growth factor receptor signaling pathway / negative regulation of exocytosis / regulation of glutamate secretion / response to iron(II) ion / regulation of norepinephrine uptake / dopamine biosynthetic process /  SNARE complex assembly / positive regulation of neurotransmitter secretion / synaptic vesicle priming / dopamine uptake involved in synaptic transmission / SNARE complex assembly / positive regulation of neurotransmitter secretion / synaptic vesicle priming / dopamine uptake involved in synaptic transmission /  regulation of macrophage activation / regulation of locomotion / mitochondrial ATP synthesis coupled electron transport / positive regulation of inositol phosphate biosynthetic process / negative regulation of microtubule polymerization / synaptic vesicle transport / dynein complex binding / positive regulation of receptor recycling / regulation of dopamine secretion / positive regulation of endocytosis / regulation of macrophage activation / regulation of locomotion / mitochondrial ATP synthesis coupled electron transport / positive regulation of inositol phosphate biosynthetic process / negative regulation of microtubule polymerization / synaptic vesicle transport / dynein complex binding / positive regulation of receptor recycling / regulation of dopamine secretion / positive regulation of endocytosis /  protein kinase inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / response to type II interferon / cuprous ion binding / positive regulation of exocytosis / synaptic vesicle exocytosis / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / response to magnesium ion / protein kinase inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / response to type II interferon / cuprous ion binding / positive regulation of exocytosis / synaptic vesicle exocytosis / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / response to magnesium ion /  kinesin binding / alpha-tubulin binding / regulation of presynapse assembly / synaptic vesicle endocytosis / negative regulation of serotonin uptake / localization / phospholipid metabolic process / supramolecular fiber organization / axon terminus / kinesin binding / alpha-tubulin binding / regulation of presynapse assembly / synaptic vesicle endocytosis / negative regulation of serotonin uptake / localization / phospholipid metabolic process / supramolecular fiber organization / axon terminus /  封入体 / cellular response to copper ion / 封入体 / cellular response to copper ion /  Hsp70 protein binding / cellular response to epinephrine stimulus / Hsp70 protein binding / cellular response to epinephrine stimulus /  excitatory postsynaptic potential / response to interleukin-1 / adult locomotory behavior / excitatory postsynaptic potential / response to interleukin-1 / adult locomotory behavior /  SNARE binding / positive regulation of release of sequestered calcium ion into cytosol / fatty acid metabolic process / long-term synaptic potentiation / regulation of transmembrane transporter activity / SNARE binding / positive regulation of release of sequestered calcium ion into cytosol / fatty acid metabolic process / long-term synaptic potentiation / regulation of transmembrane transporter activity /  ferrous iron binding / synapse organization / ferrous iron binding / synapse organization /  phospholipid binding / protein tetramerization / phospholipid binding / protein tetramerization /  phosphoprotein binding / microglial cell activation / regulation of long-term neuronal synaptic plasticity / negative regulation of protein kinase activity / tau protein binding / protein destabilization / PKR-mediated signaling / negative regulation of cysteine-type endopeptidase activity involved in apoptotic process / positive regulation of protein serine/threonine kinase activity / phosphoprotein binding / microglial cell activation / regulation of long-term neuronal synaptic plasticity / negative regulation of protein kinase activity / tau protein binding / protein destabilization / PKR-mediated signaling / negative regulation of cysteine-type endopeptidase activity involved in apoptotic process / positive regulation of protein serine/threonine kinase activity /  receptor internalization / synaptic vesicle membrane / positive regulation of inflammatory response / activation of cysteine-type endopeptidase activity involved in apoptotic process / receptor internalization / synaptic vesicle membrane / positive regulation of inflammatory response / activation of cysteine-type endopeptidase activity involved in apoptotic process /  マイクロフィラメント / positive regulation of peptidyl-serine phosphorylation / cellular response to oxidative stress / マイクロフィラメント / positive regulation of peptidyl-serine phosphorylation / cellular response to oxidative stress /  actin binding / actin binding /  細胞皮質 / 細胞皮質 /  成長円錐 / 成長円錐 /  histone binding / chemical synaptic transmission / postsynapse / neuron apoptotic process / negative regulation of neuron apoptotic process / amyloid fibril formation / response to lipopolysaccharide / histone binding / chemical synaptic transmission / postsynapse / neuron apoptotic process / negative regulation of neuron apoptotic process / amyloid fibril formation / response to lipopolysaccharide /  リソソーム / リソソーム /  oxidoreductase activity / molecular adaptor activity / transcription cis-regulatory region binding oxidoreductase activity / molecular adaptor activity / transcription cis-regulatory region binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.07 Å クライオ電子顕微鏡法 / 解像度: 3.07 Å | |||||||||
 データ登録者 データ登録者 | Li YW / Zhao CY | |||||||||
 引用 引用 |  ジャーナル: Cell Res / 年: 2018 ジャーナル: Cell Res / 年: 2018タイトル: Amyloid fibril structure of α-synuclein determined by cryo-electron microscopy. 著者: Yaowang Li / Chunyu Zhao / Feng Luo / Zhenying Liu / Xinrui Gui / Zhipu Luo / Xiang Zhang / Dan Li / Cong Liu / Xueming Li /  要旨: α-Synuclein (α-syn) amyloid fibrils are the major component of Lewy bodies, which are the pathological hallmark of Parkinson's disease (PD) and other synucleinopathies. High-resolution structure of ...α-Synuclein (α-syn) amyloid fibrils are the major component of Lewy bodies, which are the pathological hallmark of Parkinson's disease (PD) and other synucleinopathies. High-resolution structure of α-syn fibril is important for understanding its assembly and pathological mechanism. Here, we determined a fibril structure of full-length α-syn (1-140) at the resolution of 3.07 Å by cryo-electron microscopy (cryo-EM). The fibrils are cytotoxic, and transmissible to induce endogenous α-syn aggregation in primary neurons. Based on the reconstructed cryo-EM density map, we were able to unambiguously build the fibril structure comprising residues 37-99. The α-syn amyloid fibril structure shows two protofilaments intertwining along an approximate 2 screw axis into a left-handed helix. Each protofilament features a Greek key-like topology. Remarkably, five out of the six early-onset PD familial mutations are located at the dimer interface of the fibril (H50Q, G51D, and A53T/E) or involved in the stabilization of the protofilament (E46K). Furthermore, these PD mutations lead to the formation of fibrils with polymorphic structures distinct from that of the wild-type. Our study provides molecular insight into the fibrillar assembly of α-syn at the atomic level and sheds light on the molecular pathogenesis caused by familial PD mutations of α-syn. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6988.map.gz emd_6988.map.gz | 8.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6988-v30.xml emd-6988-v30.xml emd-6988.xml emd-6988.xml | 16.5 KB 16.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_6988.png emd_6988.png | 139.6 KB | ||
| Filedesc metadata |  emd-6988.cif.gz emd-6988.cif.gz | 5.2 KB | ||
| その他 |  emd_6988_additional.map.gz emd_6988_additional.map.gz emd_6988_half_map_1.map.gz emd_6988_half_map_1.map.gz emd_6988_half_map_2.map.gz emd_6988_half_map_2.map.gz | 28.4 MB 23.4 MB 23.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6988 http://ftp.pdbj.org/pub/emdb/structures/EMD-6988 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6988 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6988 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6988.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6988.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Density map calculated by applying a helical symmetry to the segments in the middle of 3D reconstruction. The twist angle is 179.64 degree and the rise is 3.39 angstrom. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.32 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: 3D reconstruction map without applying helical symmetry.
| ファイル | emd_6988_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D reconstruction map without applying helical symmetry. | ||||||||||||
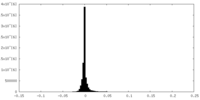
| 投影像・断面図 |
| ||||||||||||
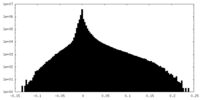
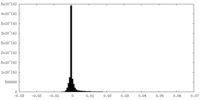
| 密度ヒストグラム |
-ハーフマップ: 3D reconstruction map using half dataset
| ファイル | emd_6988_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D reconstruction map using half dataset | ||||||||||||
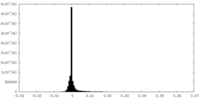
| 投影像・断面図 |
| ||||||||||||
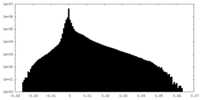
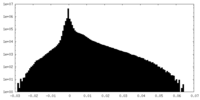
| 密度ヒストグラム |
-ハーフマップ: 3D reconstruction map using half dataset
| ファイル | emd_6988_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D reconstruction map using half dataset | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : alpha-synuclein fiber
| 全体 | 名称: alpha-synuclein fiber |
|---|---|
| 要素 |
|
-超分子 #1: alpha-synuclein fiber
| 超分子 | 名称: alpha-synuclein fiber / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Alpha-synuclein
| 分子 | 名称: Alpha-synuclein / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 6.251097 KDa |
| 組換発現 | 生物種:   Escherichia coli K-12 (大腸菌) Escherichia coli K-12 (大腸菌) |
| 配列 | 文字列: VLYVGSKTKE GVVHGVATVA EKTKEQVTNV GGAVVTGVTA VAQKTVEGAG SIAAATGFVK KDQ UniProtKB:  Α-シヌクレイン Α-シヌクレイン |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE 詳細: 4 microl of alpha-syn fibril solution was applied to a glow-discharged holey carbon grid (Quantifoil R1.2/1.3, 300 mesh), blotted for 6 s, and plunge-frozen in liquid ethane using FEI ...詳細: 4 microl of alpha-syn fibril solution was applied to a glow-discharged holey carbon grid (Quantifoil R1.2/1.3, 300 mesh), blotted for 6 s, and plunge-frozen in liquid ethane using FEI Vitrobot Mark IV. 95% humidity, 16 degrees |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 289 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-32 / 平均露光時間: 8.0 sec. / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER / 詳細: a feature less cylinder |
|---|---|
| 最終 角度割当 | タイプ: NOT APPLICABLE |
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 2.393 Å 想定した対称性 - らせんパラメータ - ΔΦ: 179.641 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 3.07 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 2.1) / 使用した粒子像数: 43677 |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X