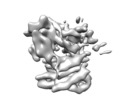
登録情報 データベース : EMDB / ID : EMD-20551タイトル Structure of a MAPK pathway complex Structure of a MAPK pathway complex 複合体 : ERK pathway complexタンパク質・ペプチド : Serine/threonine-protein kinase B-rafタンパク質・ペプチド : 14-3-3 protein zeta/delta機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト) / Human (ヒト)手法 / / 解像度 : 6.8 Å Park E / Rawson S / Jeon H / Eck MJ 資金援助 Organization Grant number 国 National Institutes of Health/National Human Genome Research Institute (NIH/NHGRI) P50CA165962 National Institutes of Health/National Cancer Institute (NIH/NCI) R50CA221830
ジャーナル : Nature / 年 : 2019タイトル : Architecture of autoinhibited and active BRAF-MEK1-14-3-3 complexes.著者 : Eunyoung Park / Shaun Rawson / Kunhua Li / Byeong-Won Kim / Scott B Ficarro / Gonzalo Gonzalez-Del Pino / Humayun Sharif / Jarrod A Marto / Hyesung Jeon / Michael J Eck / 要旨 : RAF family kinases are RAS-activated switches that initiate signalling through the MAP kinase cascade to control cellular proliferation, differentiation and survival. RAF activity is tightly ... RAF family kinases are RAS-activated switches that initiate signalling through the MAP kinase cascade to control cellular proliferation, differentiation and survival. RAF activity is tightly regulated and inappropriate activation is a frequent cause of cancer; however, the structural basis for RAF regulation is poorly understood at present. Here we use cryo-electron microscopy to determine autoinhibited and active-state structures of full-length BRAF in complexes with MEK1 and a 14-3-3 dimer. The reconstruction reveals an inactive BRAF-MEK1 complex restrained in a cradle formed by the 14-3-3 dimer, which binds the phosphorylated S365 and S729 sites that flank the BRAF kinase domain. The BRAF cysteine-rich domain occupies a central position that stabilizes this assembly, but the adjacent RAS-binding domain is poorly ordered and peripheral. The 14-3-3 cradle maintains autoinhibition by sequestering the membrane-binding cysteine-rich domain and blocking dimerization of the BRAF kinase domain. In the active state, these inhibitory interactions are released and a single 14-3-3 dimer rearranges to bridge the C-terminal pS729 binding sites of two BRAFs, which drives the formation of an active, back-to-back BRAF dimer. Our structural snapshots provide a foundation for understanding normal RAF regulation and its mutational disruption in cancer and developmental syndromes. 履歴 登録 2019年8月1日 - ヘッダ(付随情報) 公開 2019年10月2日 - マップ公開 2019年10月9日 - 更新 2020年4月22日 - 現状 2020年4月22日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 stress fiber assembly / positive regulation of axon regeneration / face development / synaptic vesicle exocytosis / somatic stem cell population maintenance /
stress fiber assembly / positive regulation of axon regeneration / face development / synaptic vesicle exocytosis / somatic stem cell population maintenance /  MAP kinase kinase activity / thyroid gland development / Regulation of localization of FOXO transcription factors /
MAP kinase kinase activity / thyroid gland development / Regulation of localization of FOXO transcription factors /  Interleukin-3, Interleukin-5 and GM-CSF signaling /
Interleukin-3, Interleukin-5 and GM-CSF signaling /  MAP kinase kinase kinase activity / phosphoserine residue binding / Activation of BAD and translocation to mitochondria / cellular response to glucose starvation / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / negative regulation of endothelial cell apoptotic process / positive regulation of substrate adhesion-dependent cell spreading / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / RHO GTPases activate PKNs / response to cAMP / negative regulation of TORC1 signaling / positive regulation of stress fiber assembly / ERK1 and ERK2 cascade / cellular response to calcium ion / negative regulation of innate immune response / substrate adhesion-dependent cell spreading / protein sequestering activity / regulation of ERK1 and ERK2 cascade / cellular response to nerve growth factor stimulus / thymus development / long-term synaptic potentiation / Translocation of SLC2A4 (GLUT4) to the plasma membrane / Deactivation of the beta-catenin transactivating complex / TP53 Regulates Metabolic Genes / Negative regulation of NOTCH4 signaling / animal organ morphogenesis / Spry regulation of FGF signaling / RAF activation / Signaling by high-kinase activity BRAF mutants /
MAP kinase kinase kinase activity / phosphoserine residue binding / Activation of BAD and translocation to mitochondria / cellular response to glucose starvation / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / negative regulation of endothelial cell apoptotic process / positive regulation of substrate adhesion-dependent cell spreading / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / RHO GTPases activate PKNs / response to cAMP / negative regulation of TORC1 signaling / positive regulation of stress fiber assembly / ERK1 and ERK2 cascade / cellular response to calcium ion / negative regulation of innate immune response / substrate adhesion-dependent cell spreading / protein sequestering activity / regulation of ERK1 and ERK2 cascade / cellular response to nerve growth factor stimulus / thymus development / long-term synaptic potentiation / Translocation of SLC2A4 (GLUT4) to the plasma membrane / Deactivation of the beta-catenin transactivating complex / TP53 Regulates Metabolic Genes / Negative regulation of NOTCH4 signaling / animal organ morphogenesis / Spry regulation of FGF signaling / RAF activation / Signaling by high-kinase activity BRAF mutants /  visual learning / MAP2K and MAPK activation / epidermal growth factor receptor signaling pathway / response to peptide hormone / Negative regulation of MAPK pathway / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants /
visual learning / MAP2K and MAPK activation / epidermal growth factor receptor signaling pathway / response to peptide hormone / Negative regulation of MAPK pathway / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants /  メラノソーム /
メラノソーム /  分裂促進因子活性化タンパク質キナーゼ / Signaling by BRAF and RAF1 fusions / cellular response to xenobiotic stimulus / presynapse /
分裂促進因子活性化タンパク質キナーゼ / Signaling by BRAF and RAF1 fusions / cellular response to xenobiotic stimulus / presynapse /  cell body / positive regulation of peptidyl-serine phosphorylation / T cell differentiation in thymus / regulation of cell population proliferation / T cell receptor signaling pathway /
cell body / positive regulation of peptidyl-serine phosphorylation / T cell differentiation in thymus / regulation of cell population proliferation / T cell receptor signaling pathway /  scaffold protein binding / blood microparticle / DNA-binding transcription factor binding / negative regulation of neuron apoptotic process / vesicle / transmembrane transporter binding / positive regulation of ERK1 and ERK2 cascade /
scaffold protein binding / blood microparticle / DNA-binding transcription factor binding / negative regulation of neuron apoptotic process / vesicle / transmembrane transporter binding / positive regulation of ERK1 and ERK2 cascade /  non-specific serine/threonine protein kinase / neuron projection /
non-specific serine/threonine protein kinase / neuron projection /  protein kinase activity /
protein kinase activity /  cadherin binding /
cadherin binding /  protein phosphorylation /
protein phosphorylation /  focal adhesion / protein serine kinase activity / intracellular membrane-bounded organelle
focal adhesion / protein serine kinase activity / intracellular membrane-bounded organelle
 Homo sapiens (ヒト) /
Homo sapiens (ヒト) / 
 Human (ヒト)
Human (ヒト) 単粒子再構成法 /
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 6.8 Å
クライオ電子顕微鏡法 / 解像度: 6.8 Å  データ登録者
データ登録者 米国, 2件
米国, 2件  引用
引用 ジャーナル: Nature / 年: 2019
ジャーナル: Nature / 年: 2019
 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_20551.map.gz
emd_20551.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-20551-v30.xml
emd-20551-v30.xml emd-20551.xml
emd-20551.xml EMDBヘッダ
EMDBヘッダ emd_20551.png
emd_20551.png http://ftp.pdbj.org/pub/emdb/structures/EMD-20551
http://ftp.pdbj.org/pub/emdb/structures/EMD-20551 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20551
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20551 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_20551.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_20551.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 MAPK/ERK pathway
MAPK/ERK pathway
 Homo sapiens (ヒト)
Homo sapiens (ヒト) non-specific serine/threonine protein kinase
non-specific serine/threonine protein kinase
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Human (ヒト)
Human (ヒト) クライオ電子顕微鏡法
クライオ電子顕微鏡法 解析
解析 単粒子再構成法
単粒子再構成法 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析 ムービー
ムービー コントローラー
コントローラー