+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20122 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | non-decorated head of the phage T5 | |||||||||
 マップデータ マップデータ | non-decorated expanded head | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  capsid (カプシド) / HK97-fold / dsDNA-phage / capsid (カプシド) / HK97-fold / dsDNA-phage /  icosahedral (二十面体) / icosahedral (二十面体) /  VIRUS (ウイルス) VIRUS (ウイルス) | |||||||||
| 機能・相同性 | viral scaffold / T=13 icosahedral viral capsid / Phage capsid / Phage capsid family / evasion of host immune response /  カプシド / Major capsid protein カプシド / Major capsid protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   Escherichia phage T5 (ファージ) Escherichia phage T5 (ファージ) | |||||||||
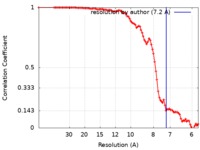
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 7.2 Å クライオ電子顕微鏡法 / 解像度: 7.2 Å | |||||||||
 データ登録者 データ登録者 | Huet A / Duda RL | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2019 ジャーナル: Proc Natl Acad Sci U S A / 年: 2019タイトル: Capsid expansion of bacteriophage T5 revealed by high resolution cryoelectron microscopy. 著者: Alexis Huet / Robert L Duda / Pascale Boulanger / James F Conway /   要旨: The large (90-nm) icosahedral capsid of bacteriophage T5 is composed of 775 copies of the major capsid protein (mcp) together with portal, protease, and decoration proteins. Its assembly is a ...The large (90-nm) icosahedral capsid of bacteriophage T5 is composed of 775 copies of the major capsid protein (mcp) together with portal, protease, and decoration proteins. Its assembly is a regulated process that involves several intermediates, including a thick-walled round precursor prohead that expands as the viral DNA is packaged to yield a thin-walled and angular mature capsid. We investigated capsid maturation by comparing cryoelectron microscopy (cryo-EM) structures of the prohead, the empty expanded capsid both with and without decoration protein, and the virion capsid at a resolution of 3.8 Å for the latter. We detail the molecular structure of the mcp, its complex pattern of interactions, and their evolution during maturation. The bacteriophage T5 mcp is a variant of the canonical HK97-fold with a high level of plasticity that allows for the precise assembly of a giant macromolecule and the adaptability needed to interact with other proteins and the packaged DNA. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20122.map.gz emd_20122.map.gz | 172.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20122-v30.xml emd-20122-v30.xml emd-20122.xml emd-20122.xml | 12.6 KB 12.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_20122_fsc.xml emd_20122_fsc.xml | 9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_20122.png emd_20122.png | 313.1 KB | ||
| Filedesc metadata |  emd-20122.cif.gz emd-20122.cif.gz | 5.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20122 http://ftp.pdbj.org/pub/emdb/structures/EMD-20122 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20122 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20122 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20122.map.gz / 形式: CCP4 / 大きさ: 474 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20122.map.gz / 形式: CCP4 / 大きさ: 474 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | non-decorated expanded head | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.11 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Escherichia phage T5
| 全体 | 名称:   Escherichia phage T5 (ファージ) Escherichia phage T5 (ファージ) |
|---|---|
| 要素 |
|
-超分子 #1: Escherichia phage T5
| 超分子 | 名称: Escherichia phage T5 / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 10726 / 生物種: Escherichia phage T5 / ウイルスタイプ: VIRUS-LIKE PARTICLE / ウイルス・単離状態: OTHER / ウイルス・エンベロープ: No / ウイルス・中空状態: Yes |
|---|---|
| 宿主 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 分子量 | 理論値: 26 MDa |
| ウイルス殻 | Shell ID: 1 / 名称: ND-head / 直径: 700.0 Å / T番号(三角分割数): 13 |
-分子 #1: Major capsid protein
| 分子 | 名称: Major capsid protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 13 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage T5 (ファージ) Escherichia phage T5 (ファージ) |
| 分子量 | 理論値: 32.931359 KDa |
| 配列 | 文字列: AVNQSSSVEV SSESYETIFS QRIIRDLQKE LVVGALFEEL PMSSKILTML VEPDAGKATW VAASTYGTDT TTGEEVKGAL KEIHFSTYK LAAKSFITDE TEEDAIFSLL PLLRKRLIEA HAVSIEEAFM TGDGSGKPKG LLTLASEDSA KVVTEAKADG S VLVTAKTI ...文字列: AVNQSSSVEV SSESYETIFS QRIIRDLQKE LVVGALFEEL PMSSKILTML VEPDAGKATW VAASTYGTDT TTGEEVKGAL KEIHFSTYK LAAKSFITDE TEEDAIFSLL PLLRKRLIEA HAVSIEEAFM TGDGSGKPKG LLTLASEDSA KVVTEAKADG S VLVTAKTI SKLRRKLGRH GLKLSKLVLI VSMDAYYDLL EDEEWQDVAQ VGNDSVKLQG QVGRIYGLPV VVSEYFPAKA NS AEFAVIV YKDNFVMPRQ RAVTVERERQ AGKQRDAYYV TQRVNLQRYF ANGVVSGTYA AS UniProtKB: Major capsid protein |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.6 構成要素:
| |||||||||||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 298 K / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 検出モード: INTEGRATING / 撮影したグリッド数: 1 / 実像数: 3628 / 平均電子線量: 30.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー