+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-0024 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the MDA5-dsRNA filament in complex with ATP (10 mM) | |||||||||
 マップデータ マップデータ | Final helical reconstruction map | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報adenyl ribonucleotide binding / MDA-5 signaling pathway / positive regulation of response to cytokine stimulus / Ub-specific processing proteases / purine ribonucleoside triphosphate binding /  pattern recognition receptor activity / negative regulation of viral genome replication / cellular response to exogenous dsRNA / type I interferon-mediated signaling pathway / positive regulation of interferon-alpha production ...adenyl ribonucleotide binding / MDA-5 signaling pathway / positive regulation of response to cytokine stimulus / Ub-specific processing proteases / purine ribonucleoside triphosphate binding / pattern recognition receptor activity / negative regulation of viral genome replication / cellular response to exogenous dsRNA / type I interferon-mediated signaling pathway / positive regulation of interferon-alpha production ...adenyl ribonucleotide binding / MDA-5 signaling pathway / positive regulation of response to cytokine stimulus / Ub-specific processing proteases / purine ribonucleoside triphosphate binding /  pattern recognition receptor activity / negative regulation of viral genome replication / cellular response to exogenous dsRNA / type I interferon-mediated signaling pathway / positive regulation of interferon-alpha production / antiviral innate immune response / protein sumoylation / ribonucleoprotein complex binding / positive regulation of interferon-beta production / response to virus / cellular response to virus / positive regulation of interleukin-6 production / pattern recognition receptor activity / negative regulation of viral genome replication / cellular response to exogenous dsRNA / type I interferon-mediated signaling pathway / positive regulation of interferon-alpha production / antiviral innate immune response / protein sumoylation / ribonucleoprotein complex binding / positive regulation of interferon-beta production / response to virus / cellular response to virus / positive regulation of interleukin-6 production /  double-stranded RNA binding / positive regulation of tumor necrosis factor production / protein complex oligomerization / defense response to virus / double-stranded RNA binding / positive regulation of tumor necrosis factor production / protein complex oligomerization / defense response to virus /  RNA helicase activity / RNA helicase activity /  single-stranded RNA binding / single-stranded RNA binding /  ヘリカーゼ / protein domain specific binding / ヘリカーゼ / protein domain specific binding /  自然免疫系 / 自然免疫系 /  ATP hydrolysis activity / ATP hydrolysis activity /  ミトコンドリア / ミトコンドリア /  DNA binding / DNA binding /  RNA binding / zinc ion binding / RNA binding / zinc ion binding /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞核 / 細胞核 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Mus musculus (ハツカネズミ) / Mus musculus (ハツカネズミ) /   Pseudomonas savastanoi pv. phaseolicola (バクテリア) / Pseudomonas savastanoi pv. phaseolicola (バクテリア) /   Pseudomonas phage phi6 (ファージ) Pseudomonas phage phi6 (ファージ) | |||||||||
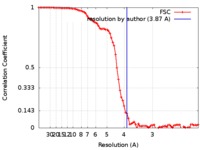
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.87 Å クライオ電子顕微鏡法 / 解像度: 3.87 Å | |||||||||
 データ登録者 データ登録者 | Yu Q / Qu K / Modis Y | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2018 ジャーナル: Mol Cell / 年: 2018タイトル: Cryo-EM Structures of MDA5-dsRNA Filaments at Different Stages of ATP Hydrolysis. 著者: Qin Yu / Kun Qu / Yorgo Modis /  要旨: Double-stranded RNA (dsRNA) is a potent proinflammatory signature of viral infection. Long cytosolic dsRNA is recognized by MDA5. The cooperative assembly of MDA5 into helical filaments on dsRNA ...Double-stranded RNA (dsRNA) is a potent proinflammatory signature of viral infection. Long cytosolic dsRNA is recognized by MDA5. The cooperative assembly of MDA5 into helical filaments on dsRNA nucleates the assembly of a multiprotein type I interferon signaling platform. Here, we determined cryoelectron microscopy (cryo-EM) structures of MDA5-dsRNA filaments with different helical twists and bound nucleotide analogs at resolutions sufficient to build and refine atomic models. The structures identify the filament-forming interfaces, which encode the dsRNA binding cooperativity and length specificity of MDA5. The predominantly hydrophobic interface contacts confer flexibility, reflected in the variable helical twist within filaments. Mutation of filament-forming residues can result in loss or gain of signaling activity. Each MDA5 molecule spans 14 or 15 RNA base pairs, depending on the twist. Variations in twist also correlate with variations in the occupancy and type of nucleotide in the active site, providing insights on how ATP hydrolysis contributes to MDA5-dsRNA recognition. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0024.map.gz emd_0024.map.gz | 5.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0024-v30.xml emd-0024-v30.xml emd-0024.xml emd-0024.xml | 24.6 KB 24.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0024_fsc.xml emd_0024_fsc.xml | 9.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0024.png emd_0024.png | 158.4 KB | ||
| マスクデータ |  emd_0024_msk_1.map emd_0024_msk_1.map | 42.9 MB |  マスクマップ マスクマップ | |
| その他 |  emd_0024_half_map_1.map.gz emd_0024_half_map_1.map.gz emd_0024_half_map_2.map.gz emd_0024_half_map_2.map.gz | 12.3 MB 12.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0024 http://ftp.pdbj.org/pub/emdb/structures/EMD-0024 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0024 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0024 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6gkmMC  0012C  0023C  0143C  0145C  4338C  4340C  4341C  6g19C  6g1sC  6g1xC  6gjzC  6gkhC  6h61C  6h66C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10208 (タイトル: mouse MDA5-dsRNA 10mM ATP Filamemt / Data size: 138.9 EMPIAR-10208 (タイトル: mouse MDA5-dsRNA 10mM ATP Filamemt / Data size: 138.9 Data #1: mouse MDA5-dsRNA filaments in complex with 10mM ATP [micrographs - single frame]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0024.map.gz / 形式: CCP4 / 大きさ: 42.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0024.map.gz / 形式: CCP4 / 大きさ: 42.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Final helical reconstruction map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_0024_msk_1.map emd_0024_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1
| ファイル | emd_0024_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_0024_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : MDA5-dsRNA helical filament in complex with ATP
| 全体 | 名称: MDA5-dsRNA helical filament in complex with ATP |
|---|---|
| 要素 |
|
-超分子 #1: MDA5-dsRNA helical filament in complex with ATP
| 超分子 | 名称: MDA5-dsRNA helical filament in complex with ATP / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 詳細: Filaments formed in the presence of 10 mM ATP and frozen 7.5 min after addition of ATP |
|---|---|
| 分子量 | 理論値: 2.171 kDa/nm |
-超分子 #2: MDA5 bound to ATP
| 超分子 | 名称: MDA5 bound to ATP / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 詳細: DExD/H-box helicase consisting of Hel1, Hel2, Hel2i, and pincer domains, followed by a C-terminal domain |
|---|---|
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) / 組換株: BL21(DE3) Escherichia coli (大腸菌) / 組換株: BL21(DE3) |
-超分子 #3: Double-stranded RNA from bacteriophage Phi6
| 超分子 | 名称: Double-stranded RNA from bacteriophage Phi6 / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2-#3 |
|---|---|
| 由来(天然) | 生物種:   Pseudomonas savastanoi pv. phaseolicola (バクテリア) Pseudomonas savastanoi pv. phaseolicola (バクテリア) |
-分子 #1: Interferon-induced helicase C domain-containing protein 1
| 分子 | 名称: Interferon-induced helicase C domain-containing protein 1 タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号:  ヘリカーゼ ヘリカーゼ |
|---|---|
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) |
| 分子量 | 理論値: 114.214477 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 配列 | 文字列: MSIVCSAEDS FRNLILFFRP RLKMYIQVEP VLDHLIFLSA ETKEQILKKI NTCGNTSAAE LLLSTLEQGQ WPLGWTQMFV EALEHSGNP LAARYVKPTL TDLPSPSSET AHDECLHLLT LLQPTLVDKL LINDVLDTCF EKGLLTVEDR NRISAAGNSG N ESGVRELL ...文字列: MSIVCSAEDS FRNLILFFRP RLKMYIQVEP VLDHLIFLSA ETKEQILKKI NTCGNTSAAE LLLSTLEQGQ WPLGWTQMFV EALEHSGNP LAARYVKPTL TDLPSPSSET AHDECLHLLT LLQPTLVDKL LINDVLDTCF EKGLLTVEDR NRISAAGNSG N ESGVRELL RRIVQKENWF STFLDVLRQT GNDALFQELT GGGCPEDNTD LANSSHRDGP AANECLLPAV DESSLETEAW NV DDILPEA SCTDSSVTTE SDTSLAEGSV SCFDESLGHN SNMGRDSGTM GSDSDESVIQ TKRVSPEPEL QLRPYQMEVA QPA LDGKNI IICLPTGSGK TRVAVYITKD HLDKKKQASE SGKVIVLVNK VMLAEQLFRK EFNPYLKKWY RIIGLSGDTQ LKIS FPEVV KSYDVIISTA QILENSLLNL ESGDDDGVQL SDFSLIIIDE CHHTNKEAVY NNIMRRYLKQ KLRNNDLKKQ NKPAI PLPQ ILGLTASPGV GAAKKQSEAE KHILNICANL DAFTIKTVKE NLGQLKHQIK EPCKKFVIAD DTRENPFKEK LLEIMA SIQ TYCQKSPMSD FGTQHYEQWA IQMEKKAAKD GNRKDRVCAE HLRKYNEALQ INDTIRMIDA YSHLETFYTD EKEKKFA VL NDSKKSLKLD ETDEFLMNLF FDNKKMLKKL AENPKYENEK LIKLRNTILE QFTRSEESSR GIIFTKTRQS TYALSQWI M ENAKFAEVGV KAHHLIGAGH SSEVKPMTQT EQKEVISKFR TGEINLLIAT TVAEEGLDIK ECNIVIRYGL VTNEIAMVQ ARGRARADES TYVLVTSSGS GVTEREIVND FREKMMYKAI NRVQNMKPEE YAHKILELQV QSILEKKMKV KRSIAKQYND NPSLITLLC KNCSMLVCSG ENIHVIEKMH HVNMTPEFKG LYIVRENKAL QKKFADYQTN GEIICKCGQA WGTMMVHKGL D LPCLKIRN FVVNFKNNSP KKQYKKWVEL PIRFPDLDYS EYCLYSDED |
-分子 #2: RNA (5'-R(P*CP*AP*AP*GP*CP*CP*GP*AP*GP*GP*AP*GP*AP*G)-3')
| 分子 | 名称: RNA (5'-R(P*CP*AP*AP*GP*CP*CP*GP*AP*GP*GP*AP*GP*AP*G)-3') タイプ: rna / ID: 2 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種:   Pseudomonas phage phi6 (ファージ) Pseudomonas phage phi6 (ファージ) |
| 分子量 | 理論値: 4.587852 KDa |
| 配列 | 文字列: CAAGCCGAGG AGAG |
-分子 #3: RNA (5'-R(P*CP*UP*CP*UP*CP*CP*UP*CP*GP*GP*CP*UP*UP*G)-3')
| 分子 | 名称: RNA (5'-R(P*CP*UP*CP*UP*CP*CP*UP*CP*GP*GP*CP*UP*UP*G)-3') タイプ: rna / ID: 3 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種:   Pseudomonas phage phi6 (ファージ) Pseudomonas phage phi6 (ファージ) |
| 分子量 | 理論値: 4.35258 KDa |
| 配列 | 文字列: CUCUCCUCGG CUUG |
-分子 #4: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 4 / コピー数: 1 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #5: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.7 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR / 詳細: 25 mA | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV | |||||||||||||||
| 詳細 | Samples were diluted twofold from 1 mg/ml to 0.5 mg/ml immediately prior to plunge freezing |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 75000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): -3.1 µm / 最小 デフォーカス(公称値): -1.7 µm Bright-field microscopy / 最大 デフォーカス(公称値): -3.1 µm / 最小 デフォーカス(公称値): -1.7 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 平均電子線量: 30.24 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 175 当てはまり具合の基準: Cross-correlation coefficient |
|---|---|
| 得られたモデル |  PDB-6gkm: |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X