+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8598 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The structure of human bocavirus 1 | |||||||||
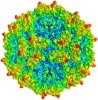
 マップデータ マップデータ | Human bocavirus 1 (VP2 expressed in Sf9 cells using recombinant baculoviruses) | |||||||||
 試料 試料 | human bocavirus 1 != Human bocavirus 1 human bocavirus 1
| |||||||||
 キーワード キーワード | HBoV1 /  human parvovirus 1 (パルボウイルス) / human parvovirus 1 (パルボウイルス) /  parvovirus (パルボウイルス) / respiratory tract infection / parvovirus (パルボウイルス) / respiratory tract infection /  VIRUS LIKE PARTICLE (ウイルス様粒子) VIRUS LIKE PARTICLE (ウイルス様粒子) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報phospholipase A2 activity => GO:0004623 / phospholipase A2 activity => GO:0004623 /  ホスホリパーゼA2 / ホスホリパーゼA2 /  phospholipase A2 activity / T=1 icosahedral viral capsid / lipid catabolic process / phospholipase A2 activity / T=1 icosahedral viral capsid / lipid catabolic process /  カプシド / host cell cytoplasm / host cell nucleus / structural molecule activity カプシド / host cell cytoplasm / host cell nucleus / structural molecule activity類似検索 - 分子機能 | |||||||||
| 生物種 |   Human bocavirus 1 (ウイルス) Human bocavirus 1 (ウイルス) | |||||||||
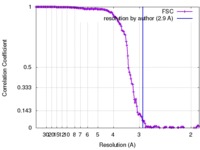
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.9 Å クライオ電子顕微鏡法 / 解像度: 2.9 Å | |||||||||
 データ登録者 データ登録者 | Mietzsch M / Kailasan S | |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2017 ジャーナル: J Virol / 年: 2017タイトル: Structural Insights into Human Bocaparvoviruses. 著者: Mario Mietzsch / Shweta Kailasan / Jamie Garrison / Maria Ilyas / Paul Chipman / Kalle Kantola / Mandy E Janssen / John Spear / Duncan Sousa / Robert McKenna / Kevin Brown / Maria Söderlund- ...著者: Mario Mietzsch / Shweta Kailasan / Jamie Garrison / Maria Ilyas / Paul Chipman / Kalle Kantola / Mandy E Janssen / John Spear / Duncan Sousa / Robert McKenna / Kevin Brown / Maria Söderlund-Venermo / Timothy Baker / Mavis Agbandje-McKenna /    要旨: Bocaparvoviruses are emerging pathogens of the family. Human bocavirus 1 (HBoV1) causes severe respiratory infections and HBoV2 to HBoV4 cause gastrointestinal infections in young children. Recent ...Bocaparvoviruses are emerging pathogens of the family. Human bocavirus 1 (HBoV1) causes severe respiratory infections and HBoV2 to HBoV4 cause gastrointestinal infections in young children. Recent reports of life-threatening cases, lack of direct treatment or vaccination, and a limited understanding of their disease mechanisms highlight the need to study these pathogens on a molecular and structural level for the development of therapeutics. Toward this end, the capsid structures of HBoV1, HBoV3, and HBoV4 were determined to a resolution of 2.8 to 3.0 Å by cryo-electron microscopy and three-dimensional image reconstruction. The bocaparvovirus capsids, which display different tissue tropisms, have features in common with other parvoviruses, such as depressions at the icosahedral 2-fold symmetry axis and surrounding the 5-fold symmetry axis, protrusions surrounding the 3-fold symmetry axis, and a channel at the 5-fold symmetry axis. However, unlike other parvoviruses, densities extending the 5-fold channel into the capsid interior are conserved among the bocaparvoviruses and are suggestive of a genus-specific function. Additionally, their major viral protein 3 contains loops with variable regions at their apexes conferring capsid surface topologies different from those of other parvoviruses. Structural comparisons at the strain (HBoV) and genus (bovine parvovirus and HBoV) levels identified differences in surface loops that are functionally important in host/tissue tropism, pathogenicity, and antigenicity in other parvoviruses and likely play similar roles in these viruses. This study thus provides a structural framework to characterize determinants of host/tissue tropism, pathogenicity, and antigenicity for the development of antiviral strategies to control human bocavirus infections. Human bocaviruses are one of only a few members of the family pathogenic to humans, especially young children and immunocompromised adults. There are currently no treatments or vaccines for these viruses or the related enteric bocaviruses. This study obtained the first high-resolution structures of three human bocaparvoviruses determined by cryo-reconstruction. HBoV1 infects the respiratory tract, and HBoV3 and HBoV4 infect the gastrointestinal tract, tissues that are likely targeted by the capsid. Comparison of these viruses provides information on conserved bocaparvovirus-specific features and variable regions resulting in unique surface topologies that can serve as guides to characterize HBoV determinants of tissue tropism and antigenicity in future experiments. Based on the comparison to other existing parvovirus capsid structures, this study suggests capsid regions that likely control successful infection, including determinants of receptor attachment, host cell trafficking, and antigenic reactivity. Overall, these observations could impact efforts to design antiviral strategies and vaccines for HBoVs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8598.map.gz emd_8598.map.gz | 81.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8598-v30.xml emd-8598-v30.xml emd-8598.xml emd-8598.xml | 10.2 KB 10.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_8598_fsc.xml emd_8598_fsc.xml | 16.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_8598.png emd_8598.png | 297 KB | ||
| Filedesc metadata |  emd-8598.cif.gz emd-8598.cif.gz | 5.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8598 http://ftp.pdbj.org/pub/emdb/structures/EMD-8598 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8598 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8598 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8598.map.gz / 形式: CCP4 / 大きさ: 242.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8598.map.gz / 形式: CCP4 / 大きさ: 242.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human bocavirus 1 (VP2 expressed in Sf9 cells using recombinant baculoviruses) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.95 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : human bocavirus 1
| 全体 | 名称:   human bocavirus 1 (ウイルス) human bocavirus 1 (ウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Human bocavirus 1
| 超分子 | 名称: Human bocavirus 1 / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 689403 / 生物種: Human bocavirus 1 / ウイルスタイプ: VIRUS-LIKE PARTICLE / ウイルス・単離状態: SEROTYPE / ウイルス・エンベロープ: No / ウイルス・中空状態: Yes |
|---|---|
| 宿主 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: viral protein 3
| 分子 | 名称: viral protein 3 / タイプ: protein_or_peptide / ID: 1 / コピー数: 60 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Human bocavirus 1 (ウイルス) Human bocavirus 1 (ウイルス) |
| 分子量 | 理論値: 60.568301 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MSDTDIQDQQ PDTVDAPQNT SGGGTGSIGG GKGSGVGIST GGWVGGSHFS DKYVVTKNTR QFITTIQNGH LYKTEAIETT NQSGKSQRC VTTPWTYFNF NQYSCHFSPQ DWQRLTNEYK RFRPKAMQVK IYNLQIKQIL SNGADTTYNN DLTAGVHIFC D GEHAYPNA ...文字列: MSDTDIQDQQ PDTVDAPQNT SGGGTGSIGG GKGSGVGIST GGWVGGSHFS DKYVVTKNTR QFITTIQNGH LYKTEAIETT NQSGKSQRC VTTPWTYFNF NQYSCHFSPQ DWQRLTNEYK RFRPKAMQVK IYNLQIKQIL SNGADTTYNN DLTAGVHIFC D GEHAYPNA SHPWDEDVMP DLPYKTWKLF QYGYIPIENE LADLDGNAAG GNATEKALLY QMPFFLLENS DHQVLRTGES TE FTFNFDC EWVNNERAYI PPGLMFNPKV PTRRVQYIRQ NGSTAASTGR IQPYSKPTSW MTGPGLLSAQ RVGPQSSDTA PFM VCTNPE GTHINTGAAG FGSGFDPPSG CLAPTNLEYK LQWYQTPEGT GNNGNIIANP SLSMLRDQLL YKGNQTTYNL VGDI WMFPN QVWDRFPITR ENPIWCKKPR ADKHTIMDPF DGSIAMDHPP GTIFIKMAKI PVPTASNADS YLNIYCTGQV SCEIV WEVE RYATKNWRPE RRHTALGMSL GGESNYTPTY HVDPTGAYIQ PTSYDQCMPV KTNINKVL UniProtKB: Minor capsid protein VP1 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | フィルム・検出器のモデル: DIRECT ELECTRON DE-20 (5k x 3k) 平均電子線量: 63.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー