+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7m6a | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | High resolution structure of the membrane embedded skeletal muscle ryanodine receptor | |||||||||||||||||||||
 要素 要素 |
| |||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN/ISOMERASE / ryanodine receptor / calcium / membrane / liposome / MEMBRANE PROTEIN-ISOMERASE complex | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-gated ion channel activity / positive regulation of sequestering of calcium ion / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / terminal cisterna / ryanodine receptor complex / ryanodine-sensitive calcium-release channel activity ...ATP-gated ion channel activity / positive regulation of sequestering of calcium ion / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / terminal cisterna / ryanodine receptor complex / ryanodine-sensitive calcium-release channel activity / response to redox state / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / 'de novo' protein folding / negative regulation of heart rate / cellular response to caffeine / skin development / FK506 binding / organelle membrane / intracellularly gated calcium channel activity / smooth endoplasmic reticulum / outflow tract morphogenesis / smooth muscle contraction / toxic substance binding / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / T cell proliferation / striated muscle contraction / voltage-gated calcium channel activity / calcium channel inhibitor activity / skeletal muscle fiber development / Ion homeostasis / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / release of sequestered calcium ion into cytosol / calcium channel complex / sarcoplasmic reticulum membrane / muscle contraction / cellular response to calcium ion / protein maturation / sarcoplasmic reticulum / calcium channel regulator activity / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / calcium-mediated signaling / sarcolemma / calcium ion transmembrane transport / calcium channel activity / Stimuli-sensing channels / Z disc / intracellular calcium ion homeostasis / disordered domain specific binding / positive regulation of cytosolic calcium ion concentration / protein refolding / protein homotetramerization / transmembrane transporter binding / calmodulin binding / signaling receptor binding / calcium ion binding / ATP binding / identical protein binding / membrane / cytoplasm 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.36 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Melville, Z. / Kim, K. / Clarke, O.B. / Marks, A.R. | |||||||||||||||||||||
| 資金援助 |  米国, 6件 米国, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2022 ジャーナル: Structure / 年: 2022タイトル: High-resolution structure of the membrane-embedded skeletal muscle ryanodine receptor. 著者: Zephan Melville / Kookjoo Kim / Oliver B Clarke / Andrew R Marks /  要旨: The type 1 ryanodine receptor (RyR)/calcium release channel on the sarcoplasmic reticulum (SR) is required for skeletal muscle excitation-contraction coupling and is the largest known ion channel, ...The type 1 ryanodine receptor (RyR)/calcium release channel on the sarcoplasmic reticulum (SR) is required for skeletal muscle excitation-contraction coupling and is the largest known ion channel, composed of four 565-kDa protomers. Cryogenic electron microscopy (cryo-EM) studies of the RyR have primarily used detergent to solubilize the channel; in the present study, we have used cryo-EM to solve high-resolution structures of the channel in liposomes using a gel-filtration approach with on-column detergent removal to form liposomes and incorporate the channel simultaneously. This allowed us to resolve the structure of the channel in the primed and open states at 3.4 and 4.0 Å, respectively, with a single dataset. This method offers validation for detergent-based structures of the RyR and offers a starting point for utilizing a chemical gradient mimicking the SR, where Ca concentrations are millimolar in the lumen and nanomolar in the cytosol. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7m6a.cif.gz 7m6a.cif.gz | 3 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7m6a.ent.gz pdb7m6a.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  7m6a.json.gz 7m6a.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7m6a_validation.pdf.gz 7m6a_validation.pdf.gz | 2.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7m6a_full_validation.pdf.gz 7m6a_full_validation.pdf.gz | 2.5 MB | 表示 | |
| XML形式データ |  7m6a_validation.xml.gz 7m6a_validation.xml.gz | 477.1 KB | 表示 | |
| CIF形式データ |  7m6a_validation.cif.gz 7m6a_validation.cif.gz | 718 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/m6/7m6a https://data.pdbj.org/pub/pdb/validation_reports/m6/7m6a ftp://data.pdbj.org/pub/pdb/validation_reports/m6/7m6a ftp://data.pdbj.org/pub/pdb/validation_reports/m6/7m6a | HTTPS FTP |
-関連構造データ
| 関連構造データ |  23692MC  7m6lC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10793 (タイトル: Cryo-electron microscopy of the liposome-embedded type 1 ryanodine receptor EMPIAR-10793 (タイトル: Cryo-electron microscopy of the liposome-embedded type 1 ryanodine receptorData size: 2.4 TB Data #1: Liposome-embedded type-1 ryanodine receptor [micrographs - multiframe]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 8分子 FHJOAGBI
| #1: タンパク質 | 分子量: 11798.501 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / 発現宿主:  #2: タンパク質 | 分子量: 565908.625 Da / 分子数: 4 / 由来タイプ: 天然 / 由来: (天然)  |
|---|
-非ポリマー , 4種, 16分子 


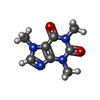



| #3: 化合物 | ChemComp-ATP / #4: 化合物 | ChemComp-CA / #5: 化合物 | ChemComp-ZN / #6: 化合物 | ChemComp-CFF / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Proteoliposomal ryanodine receptor with calstabin-2 / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: MULTIPLE SOURCES | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 2.31 MDa / 実験値: NO | ||||||||||||||||||||
| 由来(天然) | 生物種:  | ||||||||||||||||||||
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 3 mg/ml / 包埋: YES / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R0.6/1 | ||||||||||||||||||||
| EM embedding | Material: Lipid | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 4 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs: 2.7 mm |
| 試料ホルダ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 2.5 sec. / 電子線照射量: 58.34 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 11187 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2000000 | ||||||||||||||||||||||||||||
| 対称性 | 点対称性: C4 (4回回転対称) | ||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.36 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 53882 / クラス平均像の数: 41 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj








